性行为对哺乳动物物种的生存和繁殖至关重要[1]。为了最大限度地提高繁殖成功率,同时最大限度地减少消耗能量的非生产性交配,女性性行为与女性生殖周期密切相关,包括处女时期的发情周期和哺乳期[2]。在啮齿类动物中,发情的雌性对雄性表现出更强的偏好。在吸引力方面,有性经验的雄性更容易被发情的雌性所吸引。但在哺乳期,女性的性行为受到强烈抑制,并且哺乳期的雌性会攻击雄性入侵者以保护自己的孩子,这种现象被称为母性攻击[3]。尽管性激素与生殖周期的行为变化有关,但其潜在的细胞和回路机制仍不完全清楚。
腹内外侧下丘脑核的外侧亚区(VMHvlI)对女性的性行为至关重要。损伤VMHvIl会破坏许多物种的雌性性接受能力。近年来在啮齿类动物中的研究发现,VMHvIl中表达雌激素受体α (estrogen receptor alpha, Esr1)的细胞(VMHvIIEsr1)在影响雌性性行为中起重要作用。VMHvIIEsr1的失活或在VMHvIl中敲除Esr1会降低雌性的性接受能力[4]。
近些年来的研究表明VMHvlI的细胞具有分子复杂性和功能异质性。但调控雌性周期性性行为的具体机制仍不清楚。
2022年7月26日,美国纽约大学Dayu Lin实验室在Neuron发表了题为“VMHvllCckar cells dynamically control female sexual behaviors over the reproductive cycle”的研究成果,阐明了雌性小鼠的周期性交配行为的神经生物学基础[5]。
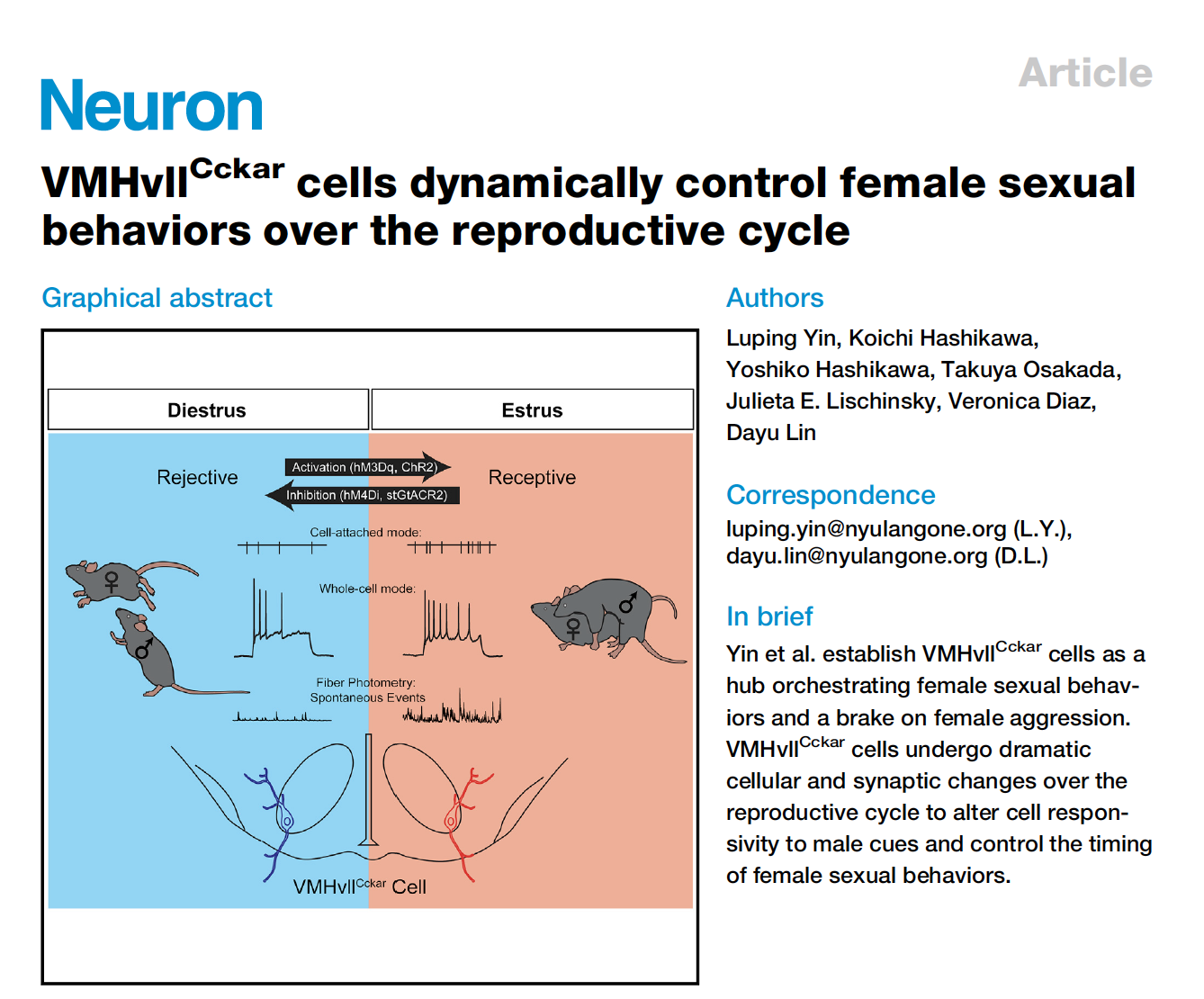
研究者们首先构建了CckarCre小鼠,并对CckarCre小鼠的有效性进行了观察。研究结果显示交配后的雌性小鼠VMHvII区表达Cckar和Fos的细胞数都高于未交配雌鼠(图1E、F)。先前的研究显示VMHvll细胞优先投射到富含雌性性行为相关的重要神经肽kisspeptin的区域--前腹侧室周核(AVPV)。为了解Cckar+细胞是否是VMHvll à AVPV投射的主要来源,研究者们向AVPV注射了retrobeads,结果显示在VMHvll中,近70%的Cckar+细胞带有标记,而超过85%的逆转录珠标记细胞表达Cckar,这表明Cckar+细胞源自AVPV的投射(图1G、H)。
研究者们还向VMHvII注射了顺行标记病毒AAV2-CAG-DIO-GFP(图1J),与逆行标记结果一致,VMHvlICckar细胞的顺行示踪显示AVPV高表达GFP(图1K、M)。除AVPV外, VMHvllCckar细胞主要作用于下丘脑内相关区域,包括内侧视前区(mPOA)、结节核(Tu)、弓状核(ARC)和下丘脑背侧内侧区(DMH)等(图1M)。总之,这些结果表明VMHvll 中的Cckar+细胞可能是优先与女性性行为相关的亚群。
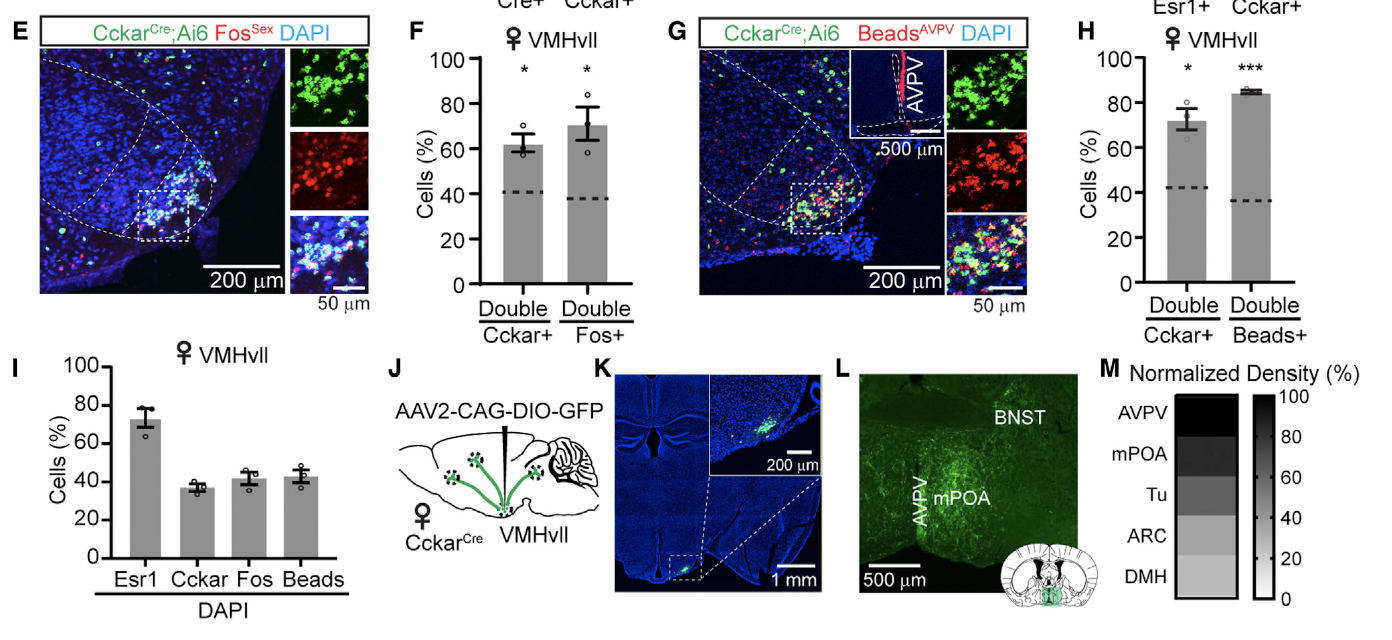
图1: CckarCre小鼠有效性验证
为了研究VMHvllCckar细胞在雌性性行为中的作用,研究者们通过化学遗传学的方式对VMHvllCckar细胞进行了调控。首先他们通过化学遗传学的手段抑制了VMHvllCckar细胞的电活动。研究者们分别向雌性CckarCre小鼠VMHvII注射了AAV2-hSyn-DIO-mCherry和AAV2-hSyn-DIO-hM4Di-mCherry病毒,并在每个测试日,首先将雌鼠与性经验丰富的成年雄性配对约10分钟,以确定其对雄鼠的接受水平,然后注射CNO或生理盐水,30分钟后再次与另一有性经验的雄性配对约10分钟(图2B)。结果显示通过化学遗传学的方式抑制VMHvllCckar细胞电活动会抑制雌性小鼠性行为,具体表现为当雄性小鼠靠近时,雌性小鼠对雄性小鼠的接触减少,并在雄性靠近时,雌鼠表现出更多的对抗行为(图2E-F),这也导致交配的成功率降低(图2G-H)。
另外研究者们还通过化学遗传学的手段激活了VMHvllCckar细胞的电活动,研究者们分别向雌性CckarCre小鼠VMHvII注射了AAV2-hSyn-DIO-mCherry和AAV2-hSyn-DIO-hM3Dq-mCherry病毒(图3A)。在CNO注射后,VMHvllCckar细胞被激活,雌性小鼠也表现出对雄性的接触增加,性交成功率也显著提升(图3D-H)。

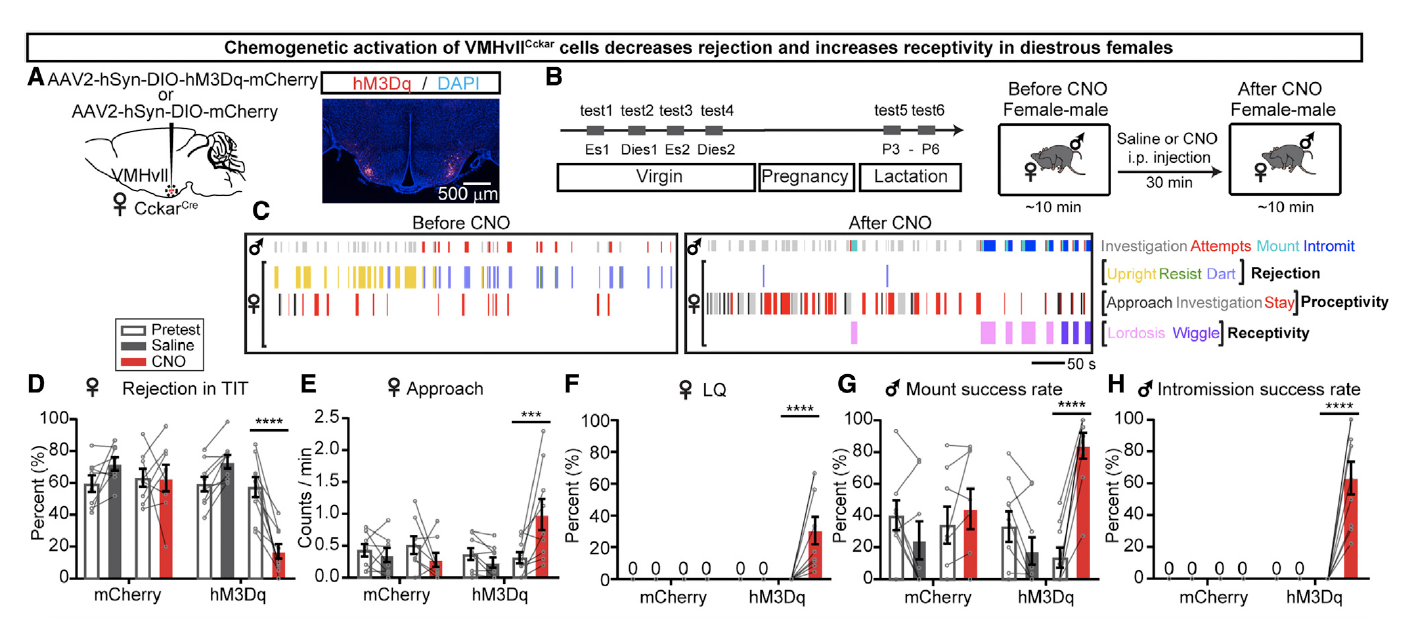
图3: 化学遗传学激活VMHvllCckar细胞促进雌性小鼠性相关行为
除了化学遗传学的方式之外,研究者们也用光遗传学的方式对现象进行了验证。研究者们分别向雌性CckarCre小鼠VMHvII注射了AAV2-CAG-DIO-GFP、AAV1-hSyn-SIO-stGtACR2-FusionRed或AAV2-EF1a-DIO-ChR2-EYFP病毒(图4A,图5A)。结果显示光遗传学抑制VMHvllCckar细胞的电活动同样会抑制雌性小鼠的性行为(图4D-K),激活VMHvllCckar细胞的电活动同样会促进雌性小鼠的性行为(图5D-M)。

图4: 光遗传学抑制VMHvllCckar细胞抑制雌性小鼠性相关行为
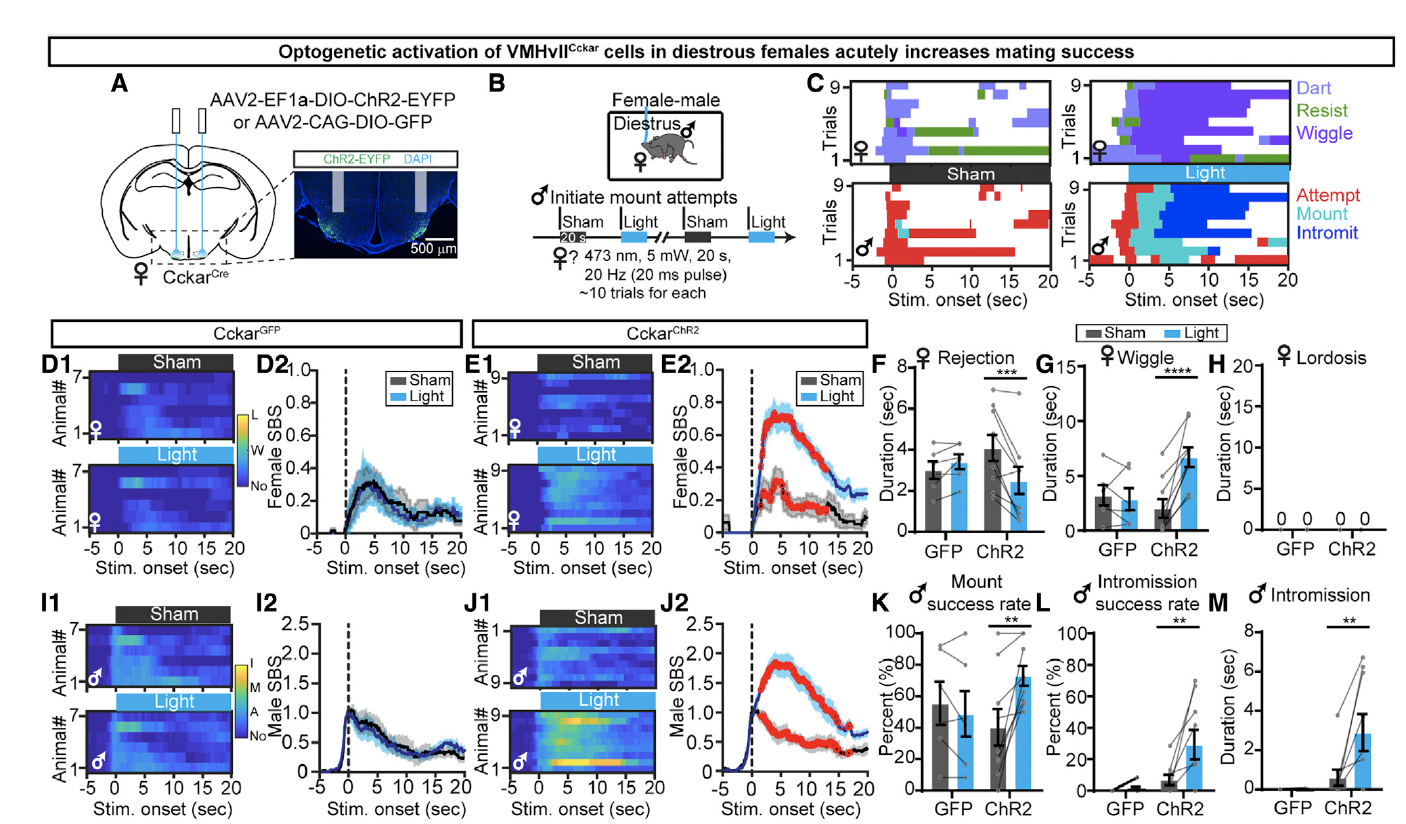
图5: 光遗传学激活VMHvllCckar细胞促进雌性小鼠性相关行为
那么VMHvllCckar细胞在雌性交配行为中的电活动是怎样的呢?研究者们向CckarCre雌鼠的VMHvII区注射了AAV1-hSyn-DIO-GCaMP6s,从而可以观察VMHvllCckar细胞的电活动(图6A)。通过光纤记录发现相较于哺乳期和非发情期,发情期雌性小鼠VMHvllCckarCa2+瞬变发生的频率更高,幅度也更高(图6D-6F)。在并且在有雄性小鼠靠近时,发情期雌性小鼠VMHvllCckarCa2+水平明显高于其他时期(图6G-L)。

图6: VMHvllCckar细胞电活动与雌性发情期相关
为了更好控制嗅觉输入的模式,研究人员将表达GCaMP6s的雌鼠头部固定,随后将刺激动物(成年雄性,成年雌性、年轻雄鼠和玩具鼠)麻醉,并依次递送到雌鼠鼻侧,观察VMHvllCckar细胞对不同类型动物的嗅觉刺激的反应(图6A、图7A、B)。研究者们发现当雌性小鼠闻到成年雄鼠的气味时,VMHvllCckar细胞钙活动显著增强,但雌鼠对雌鼠、年轻雄鼠和玩具鼠则不会有强烈的钙信号响应(图6C-H)。
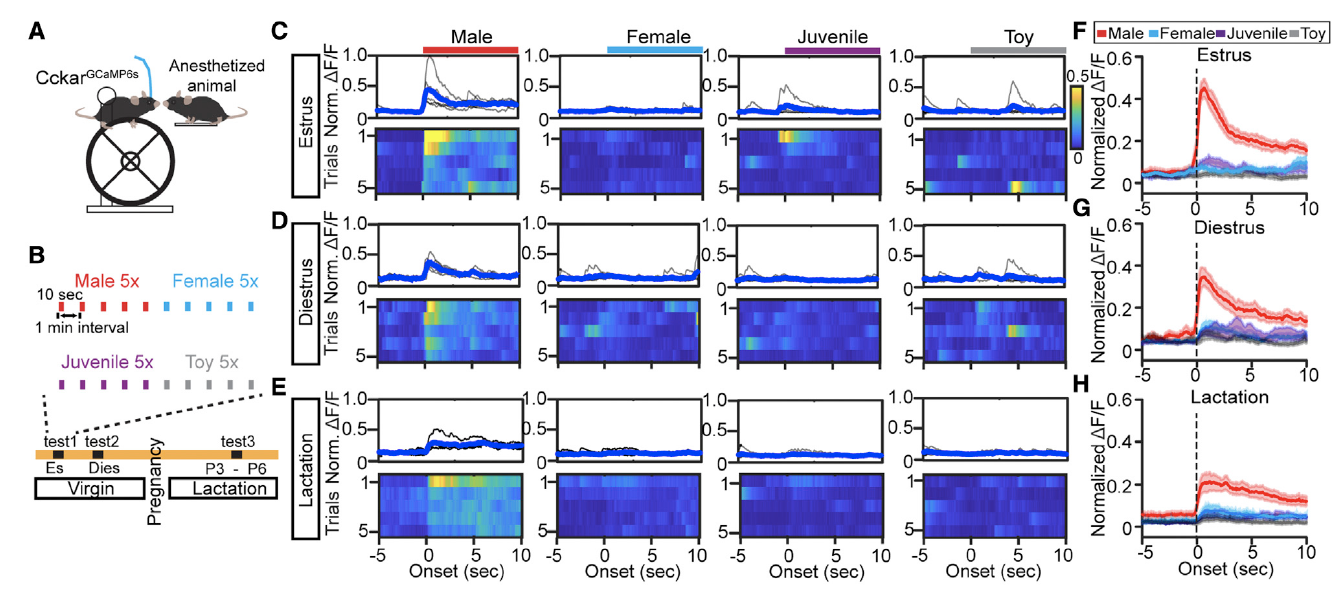
图7:成年雄鼠会诱发雌鼠VMHvllCckar细胞电活动
总之,这项工作发现了VMHvllCckar对雌性性行为的关键性调控作用。在雌性小鼠中,VMHvllCckar细胞的失活会降低它们对雄性小鼠的兴趣和性接受能力,而激活这些细胞则会产生相反的效果。并且雌性的性行为在整个生殖周期内变化很大。在体光纤记录显示VMHvllCckar细胞的自发活性和反应依赖于生殖状态的变化,在发情期间活动最高。这项研究对雌性性行为的调控机制有重要作用。

病毒实验帮 公众号底部菜单栏【新功能】上线!
免费在线学习《国自然热点研究》、《数据库及软件操作教程》
一键下载《病毒使用手册》、《高分文献》
还有不定时的送新书、抽奖活动,赶紧来扫码关注一波吧
