虽然代谢最初被认为在细胞生物学中起被动作用,通过产生ATP来满足生物能量需求,除产生ATP外,代谢为磷脂、氨基酸和核苷酸合成提供碳前体以维持细胞分裂,最近研究还证实代谢在新物质生成和为组蛋白和DNA表观遗传修饰提供专属性底物方面具有关键作用。本综述详细介绍了糖酵解和三羧酸循环产生的代谢物是如何被成体干细胞用来维持细胞增殖,及成体干细胞如何整合外部代谢和内在代谢机制来调节细胞命运,相关成果发表于《Cell Metabolism》。
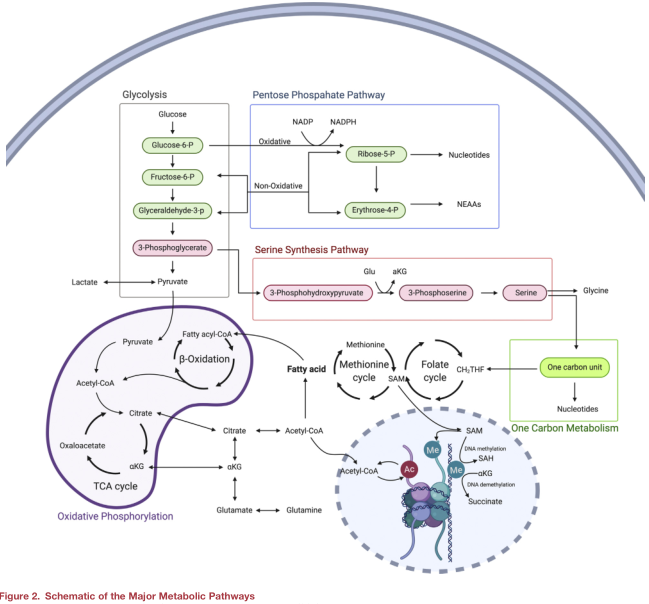
细胞中ATP的两个主要来源是糖酵解和氧化磷酸化(OxPhos)。糖酵解是一个快速的过程,可以将单个葡萄糖分子转化为两分子丙酮酸,净获得两个ATP。糖酵解产生的丙酮酸会以两种方式进一步代谢,一种方式是丙酮酸转化为乳酸并从细胞中排出,另一种方式是在氧气充足的条件下,丙酮酸运输到线粒体中并被氧化成乙酰辅酶A进入三羧酸(TCA)循环和驱动OxPhos。除了葡萄糖生成的丙酮酸发挥作用外,乙酰辅酶A可以通过脂肪酰辅酶A的β氧化提供丰富但缓慢的ATP。尽管OxPhos能量效率较高,但许多高度增殖的细胞类型如癌细胞都优先利用糖酵解。这种对糖酵解的偏好最早由Otto Warburg教授发现,并提出肿瘤发生是由线粒体功能缺陷导致对糖酵解的依赖增加而诱导的。但这种被称为需氧糖酵解方式后来被证明不是由于OxPhos缺陷引起的,而是细胞对新的生物量如磷脂、核苷酸和氨基酸的需要所驱动。重要的是,这种生物量大部分是通过糖酵解及其相互连接的旁路途径即磷酸戊糖途径和丝氨酸生物合成途径产生。
磷酸戊糖途径(PPP)是一个完整的系列反应,在生物合成和氧化还原反应中起重要作用。PPP又分为氧化途径和非氧化途径,氧化途径负责将6-磷酸葡萄糖(G6P)分解为二氧化碳、5-磷酸核酮糖和两分子NADPH。生成的NADPH是维持细胞氧化还原状态的强还原剂。非氧化途径中,6-磷酸-果糖(F6P)和3-磷酸-甘油(G3P)被代谢成5-磷酸-核糖和4-磷酸-赤藓糖。4-磷酸赤藓糖可作为芳香族氨基酸(如组氨酸)合成前体。重要的是,PPP分支中产生的5-磷酸-核糖是用于合成嘌呤和嘧啶核苷酸的糖主体。有趣的是,PPP氧化途径产生的5-磷酸-核酮糖也可以通过核糖-5-磷酸异构酶(RPI)转化为5-磷酸核糖进入非氧化途径。通过这种方式,PPP的两个途径都可以为核苷酸和非必需氨基酸(NEAAs)从头合成提供所需的碳。
第二个关键旁路途径是丝氨酸合成途径(SSP)。虽然细胞通常从细胞外环境获取丝氨酸, 但大量证据表明SSP对高度增殖细胞群(如致癌细胞)提供丝氨酸至关重要。SSP将糖酵解生成的3-磷酸甘油酸在磷酸甘油酸脱氢酶(PHGDH)、磷酸丝氨酸氨基转移酶(PSAT)和磷酸丝氨酸磷酸酶(PSPH)作用下逐步代谢为丝氨酸。值得注意的是,PSAT介导3-磷酸羟基丙酮酸(PHP)转化为3-磷酸丝氨酸需要消耗谷氨酸并产生α-酮戊二酸(αKG),αKG是TCA循环关键中间代谢物,也是DNA和组蛋白去甲基化的必需底物。在其合成之后,丝氨酸作为许多促进细胞增殖的生物分子的重要前体,如同源NEAAs、半胱氨酸和甘氨酸的合成,甘氨酸随后用于嘌呤核苷酸和抗氧化剂谷胱甘肽的生成。丝氨酸还可以通过生成鞘氨醇(合成鞘磷脂所必需的物质)并可作为磷脂头基团的前体维持新细胞膜的生成。除了用于磷脂和NEAAs合成外,SSP途径通过丝氨酸羟甲基转移酶(SHMT)生成甘氨酸为一碳代谢提供碳源。一碳代谢途径可结合叶酸和蛋氨酸循环,有助于核苷酸合成、脂质代谢及维持细胞氧化还原平衡。更重要的是,一碳代谢对S-腺苷蛋氨酸(SAM)的生成至关重要,而SAM是组蛋白和DNA甲基化专属性代谢物。
线粒体不单是“细胞的动力源”
当氧气充足时,来自脂肪酸氧化(FAO)或糖酵解的乙酰辅酶A在线粒体中与草酰乙酸结合生成柠檬酸。柠檬酸首先转化为异柠檬酸,然后转化为αKG,产生CO2, H+和NADH。然后αKG经脱羧作用形成琥珀酰辅酶A,并生成NADH和H+。磷酸化的琥珀酰辅酶A可以产生琥珀酸,其通过氧化和水合过程再生成草酰乙酸和NADH和H+。TCA循环的总体结果是乙酰辅酶A脱羧生成CO2、NADH和H+。所产生的NADH和H+可以被电子传递链(ETC)利用形成化学渗透质子梯度产生ATP。几十年来,线粒体研究的主要焦点一直与它在ATP生成中的作用有关,但这种简单化的观点正在迅速改变,TCA循环已经成为了NEAA合成、DNA和组蛋白翻译后修饰所必需的代谢物生成的关键调控因子。例如,柠檬酸可以从线粒体输出到细胞质中,并被ATP柠檬酸裂解酶(ACLY)转化为乙酰辅酶A,用于组蛋白或非组蛋白的乙酰化,或用于脂肪酸的生物合成。同样,线粒体αKG是由异柠檬酸脱羧产生,也可由谷氨酸脱氨基产生。考虑到它在DNA和组蛋白去甲基化中的作用,该代谢物调节细胞命运的作用得到重点关注也不足为奇。
细胞代谢调节表观遗传特征
细胞代谢为蛋白质、组蛋白和DNA翻译后修饰酶提供专属性底物或辅助因子。组蛋白和DNA的磷酸化、巴豆酰化、琥珀酰化、丁酰化、乙酰化和甲基化对染色质可及性和转录都有显著影响,并且都受代谢物可用性调控,而这些关键的表观调控代谢物的主要来源是三羧酸循环。
组蛋白乙酰化和其他酰化作用
组蛋白乙酰化可增加转录因子结合染色质的可及性,从而增加基因转录。有趣的是,虽然乙酰辅酶A可以从FAO、氨基酸分解和糖酵解得到,但研究人员发现,细胞主要依赖糖酵解中丙酮酸的氧化脱羧作用来实现组蛋白乙酰化,而葡萄糖来源的乙酰辅酶A的缺失会显著损害组蛋白乙酰化。最近研究发现,在乙酰辅酶A合成酶短链家族成员2 (ACSS2)的催化作用下,乙酸可以用于合成胞质乙酰辅酶A。柠檬酸来源的乙酰辅酶A耗尽后(通过ACL基因敲除实现),细胞通过ACSS2的代偿性上调维持细胞活力和从头合成脂质。然而,ACSS2只能部分恢复ACL敲除后组蛋白乙酰化水平,表明柠檬酸来源的乙酰辅酶A是组蛋白乙酰化的主要底物。细胞的代谢状态也可能通过组蛋白乙酰化对转录活性产生负面影响。乙酰辅酶A能自发地乙酰化或去乙酰化赖氨酸残基主要取决于局部乙酰辅酶A浓度。通过这种方式,整体的基因表达可以被代谢物的可用性被动的调节,也表明了代谢通量的作用。此外,组蛋白酰基化可由酰基辅酶A可用性进行调节,因此它被认为是细胞代谢状态的一个重要整合者。研究表明,线粒体代谢通过TCA循环(乙酰化和琥珀酰化)和β-氧化(巴豆酰化和丁酰化)产生的酰基部分调节染色质可及性方面起着重要作用。
组蛋白和DNA甲基化
组蛋白甲基化也与转录激活/抑制相关,而DNA甲基化通常导致转录抑制。在组蛋白和DNA甲基化中,甲基供体主要是由蛋氨酸和ATP缩合产生的SAM提供。SAM生成所需的碳来自苏氨酸、甘氨酸、丝氨酸参与的叶酸代谢途径。值得注意的是,甲基化四氢叶酸(N5-MTHF)也可以提供甲基,但在大多数情况甲基来自SAM。组蛋白和DNA去甲基化过程需要消耗αKG并释放琥珀酸,说明去甲基化与细胞代谢、细胞内αKG的可用性直接相关。反过来,富马酸和琥珀酸可作为αKG拮抗剂抑制αKG依赖性双加氧酶的活性。所以组蛋白和DNA甲基化可通过改变代谢中间体的水平进行调控。
组蛋白磷酸化
组蛋白磷酸化发挥多种生物学效应,包括DNA损伤和修复、细胞分裂中染色质压实以及诱导细胞凋亡。不同于组蛋白乙酰化明确的性质,同一位点的磷酸化会根据细胞环境导致明显的分化作用。例如,在有丝分裂和减数分裂期间H3S10p和H3S28p残基的磷酸化参与染色质压实,但在染色质松弛阶段则激活转录。代谢可通过启动激酶激活的信号级联反应间接影响组蛋白磷酸化,但是否能直接改变磷酸基团的可用性仍有待确定。
细胞营养感知
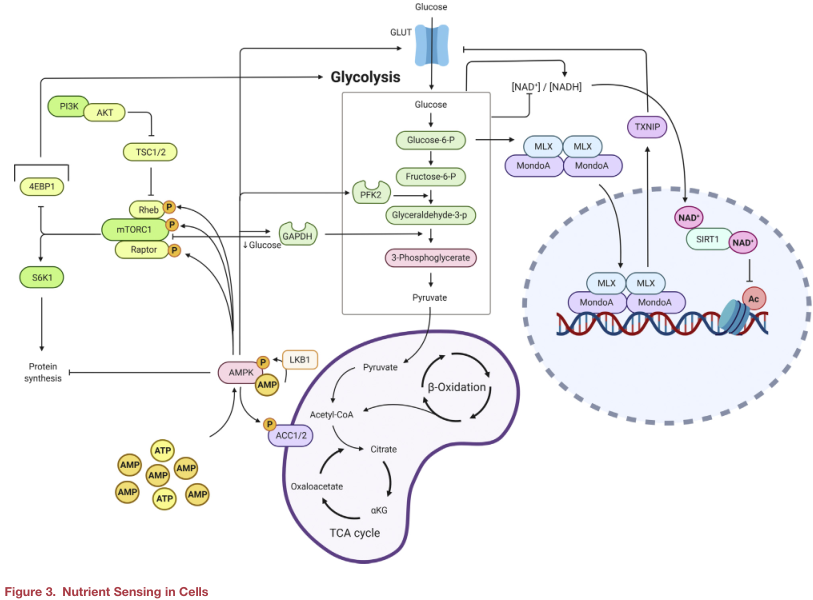
生态代谢环境在维持成体干细胞命运的体内平衡中发挥怎样的作用?此外,损伤或创伤通常会导致生态位代谢环境的破坏,干细胞暴露在新的代谢环境中,是否会影响细胞的命运也是一个问题。局部代谢环境变化和细胞命运之间的沟通是通过几个关键的营养传感器,它们将细胞外环境的变化转化为细胞的固有信号(或信号),如TXNIP、mTOR、AMPK和组蛋白去乙酰化酶的sirtuin家族。
硫氧还蛋白相互作用蛋白--葡萄糖利用看门人
硫氧还蛋白相互作用蛋白(TXNIP)是一种α-抑制蛋白,具有调节糖酵解、氧化应激和细胞增殖等多种生物学功能。TXNIP与硫氧还蛋白(TRX) 1和2相互作用并结合,抑制TRX的抗氧化特性,导致细胞内氧化应激增加。TXNIP也通过抑制GLUT1活性和转录抑制糖酵解通量。细胞内葡萄糖和G6P升高可促进Txnip转录,进而导致TXNIP介导的葡萄糖摄取减少。因此,TXNIP与G6P在负反馈回路中调节葡萄糖摄取。此外,TXNIP在调节细胞增殖方面也具有重要作用。
雷帕霉素:生长与营养的交点
雷帕霉素(mTOR)由两个复合物(mTORC1和mTORC2)组成,它们的作用既有重叠又有不同。两种复合物都会对刺激物(胰岛素和IGF-1)、氨基酸和葡萄糖水平、能量状态和细胞氧水平做出反应。特别是营养成分和氨基酸是mTORC1通路有效激活剂,可对下游靶点4EBP1和S6K1磷酸化,从而启动mRNA翻译、糖酵解和生物合成。mTORC活性由其上游调节剂控制,包括负调节剂TSC1/2。TSC1/2活性缺失导致GTP结合的Rheb出现积累和mTORC1的活化。重要的是,mTORC1信号的改变在细胞命运中起着重要的作用。MuSCs静止状态下发现了一个不同的G0期,在静止G0期和激活启动状态之间过渡,称为GAlert期。这两种细胞状态之间的转换受到mTORC1信号调控,这可能与静止状态下环境营养可获得性有关。
AMPK
5'AMP活化蛋白激酶(AMPK)是细胞中最具特征的能量传感器。鉴于AMPK对磷酸化腺苷核苷酸水平的敏感性,AMPK在细胞感知营养利用率和对变化作出反应的能力中具有至关重要的作用,活化的AMPK通过促进葡萄糖转运蛋白的表达和活化直接影响葡萄糖稳态,通过磷酸化6-磷酸果糖-2-激酶促进果糖2-6二磷酸生成并激活糖酵解。AMPK还可以通过乙酰辅酶A羧化酶1/2 (ACC1/2)的磷酸化调控脂质代谢。AMPK除了调节代谢和生长外,还参与启动适应性代谢重编程反应。在这种能力下,AMPK磷酸化并调节参与细胞表观遗传的转录因子、辅酶因子活性,包括HAT p300, HDACs,甚至组蛋白本身。虽然研究已经揭示了AMPK在表观基因组中的调控作用,但其如何影响细胞生长和细胞命运仍有待探索。
Sirtuins蛋白
Sirtuins是由7种组蛋白/蛋白去乙酰化酶(SIRT1-7)组成,其活性主要依赖于NAD+的可用性,在功能上将其活性与营养物质的可用性和先天细胞代谢联系起来。Sirtuins介导组蛋白和非组蛋白的乙酰化状态来调控细胞增殖、存活和衰老。不过相关研究结果显示SIRT1介导调控细胞命运具有一定复杂性,提示其作用可能取决于特定的代谢微环境。
小结
本文对细胞命运与代谢的联系进行系统总结,线粒体既是能量发生器,又是体细胞和多能细胞双向转换的推动者,为发育生物学开辟了新的研究视野。代谢中活性小分子可诱导代谢重编程和影响干细胞功能。一种值得注意的方法是将关键代谢物或小分子微粒直接注射到组织或损伤部位以促进再生,如在耳廓损伤后局部给予2-脱氧-D-葡萄糖(2-DG),证实可增强耳朵再生。也有研究已经证明靶向代谢(热量限制)可增强移植后干细胞的移植。此外,干细胞的激活状态和代谢状态的显著变化相关。目前对于改变代谢状态控制干细胞在体外状态和功能仍知之甚少,且干细胞群体存在巨大异质性,因此研究干细胞代谢前仍需建立更为成熟的单细胞水平代谢检测平台和技术。
参考文献
Ly C H , et al. A Metabolic Roadmap for Somatic Stem Cell Fate. Cell Metabolism, 2020, 31(6).
原文阅读,请长按识别下方二维码

精彩推荐
1. Nature reviews Molecular cell Biology | 小分子代谢物如何调控上游大分子
5. NCB | 葡萄糖饥饿诱导的细胞死亡:胱氨酸调控戊糖磷酸途径依赖和二硫化物胁迫

