![]()

先前在小鼠中进行的单细胞RNA测序 (scRNA-seq) 研究表明,小胶质细胞具有高度异质性,以及小胶质细胞发育的相关复杂性[6]。然而,人类和小鼠之间的物种差异极大地限制了我们对人类小胶质细胞分化和功能的理解,特别是在早期胚胎发育过程中。而有关人类的单细胞测序研究仅研究了小胶质细胞从卵黄囊到进入大脑前的早期起源阶段[7],或难以CNS中不同区域小胶质细胞的发育进行差异化研究[8]。2022年4月7日,中国科学院动物研究所干细胞与生殖生物学国家重点实验室焦建伟研究团队与多家单位强强联合,在Cell Stem Cell杂志上发表题为Decoding the temporal and regional specification of microglia in the developing human brain的研究文章,基于卵黄囊组织以及不同发育阶段下四个不同脑区中小胶质细胞的单细胞转录组,表征并可视化分析了CNS中小胶质细胞区域规范的命运决定和状态转变。研究团队初次定义了包括原始髓系细胞、增殖性小胶质细胞、神经元基因富集小胶质细胞、免疫相关小胶质细胞在内的四种主要类型的小胶质细胞,并发现在人和小鼠两个物种之间小胶质细胞的状态转换是保守的,但是在分子水平上存在差异。
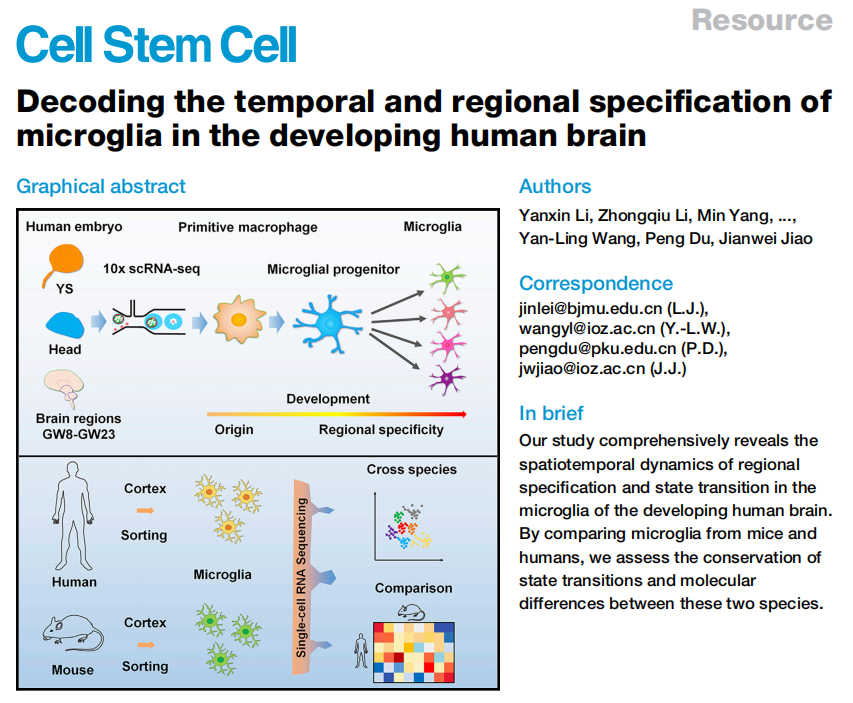
作者团队的核心工作是对获取的人类胚胎细胞进行scRNA-seq分析。通过UMAP方法,团队对所得的数据进行降维可视化处理。研究中每个细胞依自身RNA转录谱特征被投影到UMAP构建的二维坐标中并显示出20个细胞簇,进一步被归纳为4个大类,即:原始髓系细胞、增殖性小胶质细胞、神经元基因富集小胶质细胞和免疫相关小胶质细胞。其中免疫相关小胶质细胞数量最多,且可以被划分为分化中的免疫中间型和更加成熟的免疫特化型(图1. a,b)。随后,作者通过进一步分析确定了每个细胞簇的基因身份(图1. c),并同步分析了每个大类中富集到的基因(图1. d),不同类小胶质细胞基因的富集情况与其生物学功能存在着明显的相关性。 接下来,作者分析了胚胎发育不同时期下人脑各个脑区中(大脑皮层-Cor, 间脑-Dien,中脑-Mid和小脑-Cere)不同小胶质细胞簇的分布情况(图1. e)。并整理出了不同脑区中,小胶质细胞的发育轨迹(图2)。之后,为了对胚胎发育过程中区域特化小胶质细胞的分子特征和调控网络进行验证,同时比较人和小鼠胚胎中小胶质细胞的状态转变特点,作者通过免疫染色方法分别分析了人和小鼠切片。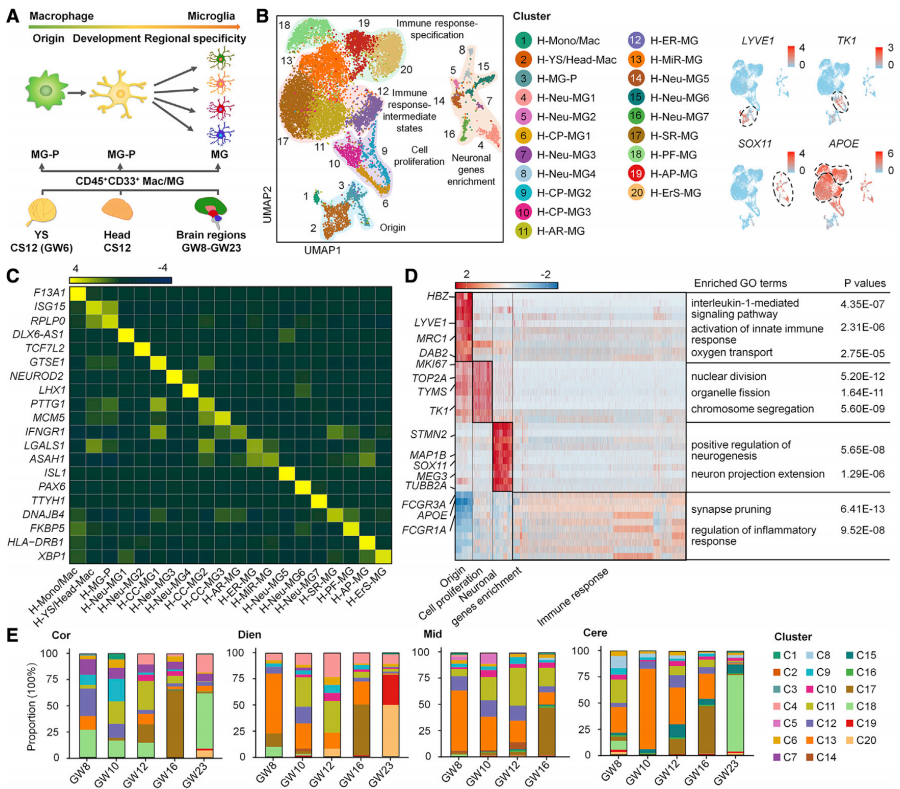
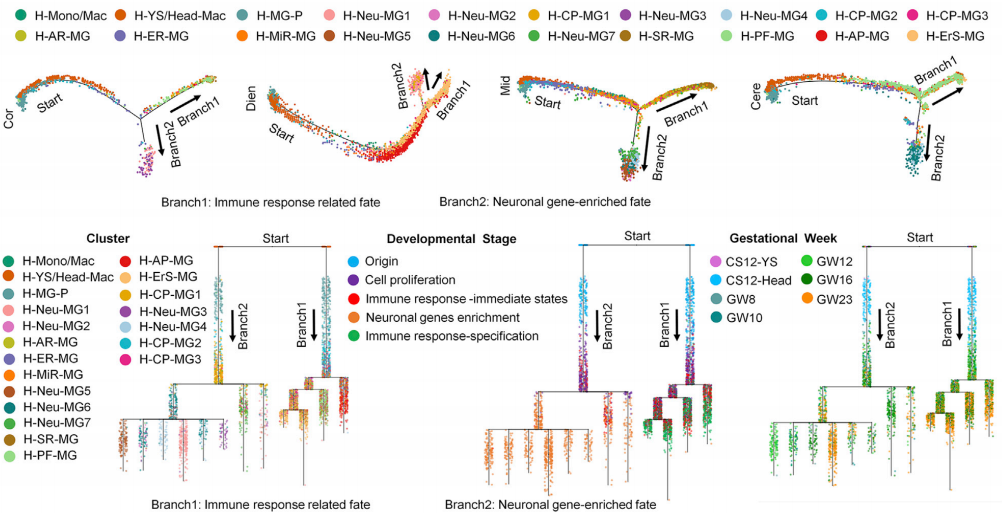
分析过程中,免疫相关小胶质细胞引起了作者的关注。其中,C18-1亚簇的小胶质细胞富含包括 FSCN1, ADGRG1, LAP3, HTRA1 ,C1QA, BIN1, HCST 和 FPR1等与“突触修剪”相关的基因,而C18-2亚簇则通过富集NUPR1, CXCR4, PLIN2, S100A1, LGALS3, CCL3L 和ADM等典型的炎症基因,激活了C18-1亚簇的“突触修剪”功能(图3. a)。上述过程中,受体配体对 MIF-(CD74 + CXCR4) 在炎症反应中发挥了重要的作用。为验证这一点,作者使用Bioss抗体对CXCR4和小胶质细胞表面标志物IBA1进行了共免疫染色(图3. b)。此外,特异性高表达的NUPR1能作为转录调节因子,可以将应激信号转化为细胞内基因表达程序,从而赋予细胞抵抗微环境变化引起的能力。使用Bioss抗体对NUPR1和小胶质细胞表面标志物IBA1进行共免疫染色发现:高表达的IBA1+ 细胞比例在GW23人类胚胎和P20小鼠中显著的不同(图3. c,d),这一结果说明人和小鼠发育时小胶质细胞的状态转换过程中,细胞在分子水平上存在明显的不同。
相关产品信息
|
编号 |
英文名称 |
种属(已验证) |
|
Rabbit Anti-NUPR1 pAb |
Hu, Mo |
|
|
Rabbit Anti-CXCR4 pAb |
Hu, Mo, Rat |
|
|
Rabbit Anti-NAV3 pAb |
Hu, Mo |
随着生物信息学的不断发展和测序技术的逐代优化,基于信息学的生物组学分析在生命科学研究中发挥的关键作用正在受到越来越多人的重视。本文作者解码了源自相同祖细胞的小胶质细胞的区域规范性发育路径,并确定了新的小胶质分类和细胞簇。在描述人类胚胎中小胶质细胞的不同激活状态后,作者分析并证明了小胶质细胞的状态转换在人和小鼠之间是保守的,但是在分子水平上存在差异。这项研究成功地应用scRNA-seq对人胚胎中小胶质细胞发育路径进行了细致描绘,解开了发育生物学领域的又一个黑匣子!努力的汗水不应被一遍遍的重复实验所埋没,创意和灵感更需要信得过的试剂给予支撑。给博奥森一份信任,我们还你的不只是一支好抗体!
参考文献
1.Salter MW, Beggs S. Sublime microglia: expanding roles for the guardians of the CNS. Cell. 2014;158(1):15-24.
2.Ginhoux F, Guilliams M. Tissue-Resident Macrophage Ontogeny and Homeostasis. Immunity. 2016;44(3):439-449.
3.Ginhoux F, Lim S, Hoeffel G, Low D, Huber T. Origin and differentiation of microglia. Front Cell Neurosci. 2013;7:45. Published 2013 Apr 17.
4.Prinz M, Erny D, Hagemeyer N. Ontogeny and homeostasis of CNS myeloid cells [published correction appears in Nat Immunol. 2017 Jul 19;18(8):951]. Nat Immunol. 2017;18(4):385-392.
5.Popova G, Soliman SS, Kim CN, et al. Human microglia states are conserved across experimental models and regulate neural stem cell responses in chimeric organoids. Cell Stem Cell. 2021;28(12):2153-2166.e6.
6.Masuda T, Sankowski R, Staszewski O, et al. Spatial and temporal heterogeneity of mouse and human microglia at single-cell resolution [published correction appears in Nature. 2019 Apr;568(7751):E4]. Nature. 2019;566(7744):388-392.
7.Bian Z, Gong Y, Huang T, et al. Deciphering human macrophage development at single-cell resolution. Nature. 2020;582(7813):571-576.
8.Kracht L, Borggrewe M, Eskandar S, et al. Human fetal microglia acquire homeostatic immune-sensing properties early in development. Science. 2020;369(6503):530-537.
