要做动物实验了,你是否会焦虑的不知从何下手啊!
实验室没有做AAV的动物实验,没人指导,我需要首先了解和确定哪些基础信息呢?
别急,小编这就带你理理思路:
对AAV你了解多少?它有哪些优势和不足?
明确自己的目的细胞类型或者靶向器官是什么?
针对目的部位,哪种注射方式效果更佳?
目的细胞类型或器官是否有特异性启动子呢?启动子该怎么选?
那么多血清型,用哪个合适呢?
AAV的滴度多少合适呢?应该注射多少的量呢?
什么时候取样观察呀?
AAV有哪些优势和不足?
目前尚未发现野生型AAV对人体致病(80%的人感染过AAV),重组AAV去除了野生型AAV基因组的96%,进一步保证了安全性,是目前最理想的基因治疗载体。
AAV作为基因载体有多方面的优势:
A.NIH对于生物技术制品的相关评级,腺相关病毒载体(AAV)属于RG1,最安全等级:腺相关病毒(AAV)不插入基因组,不改变基因组结构,因而没有潜在的致瘤性。
B.AAV具有广泛的宿主范围,对分裂细胞和非分裂细胞均具有感染能力。有比较强的靶向性,可以选择特定的器官进行转染。物理性质稳定。在60℃不能被灭活,能抗氯仿。
C.AAV的免疫原性低,基本不引起机体免疫排斥和炎症反应,能保持持久的体内留存能力和表达能力。
D.AAV可以保持基因长期转录表达,在体内表达一般在3-4周可以达到高峰,随后持续表达,作用时间>5个月;甚至有临床实验2年后仍可以检测到其表达。
E:在体内感染特异性效果好,包括感染能力和感染的特异性。
局限性:
A.不适合大片段基因的导入:AAV载体一般只能带不超过4.7kb外源基因,这还包括了启动子的长度。
B.体外实验表达水平较低:AAV病毒的基因组是单链 DNA,在体外环境形成双链并转录翻译外源基因的效率非常低。
C.需较长时间开始表达:AAV在感染后需要较长的时间来表达外源基因,所以感染AAV后建议至少 1 周后做检测。
1
怎么确定合适的注射方式
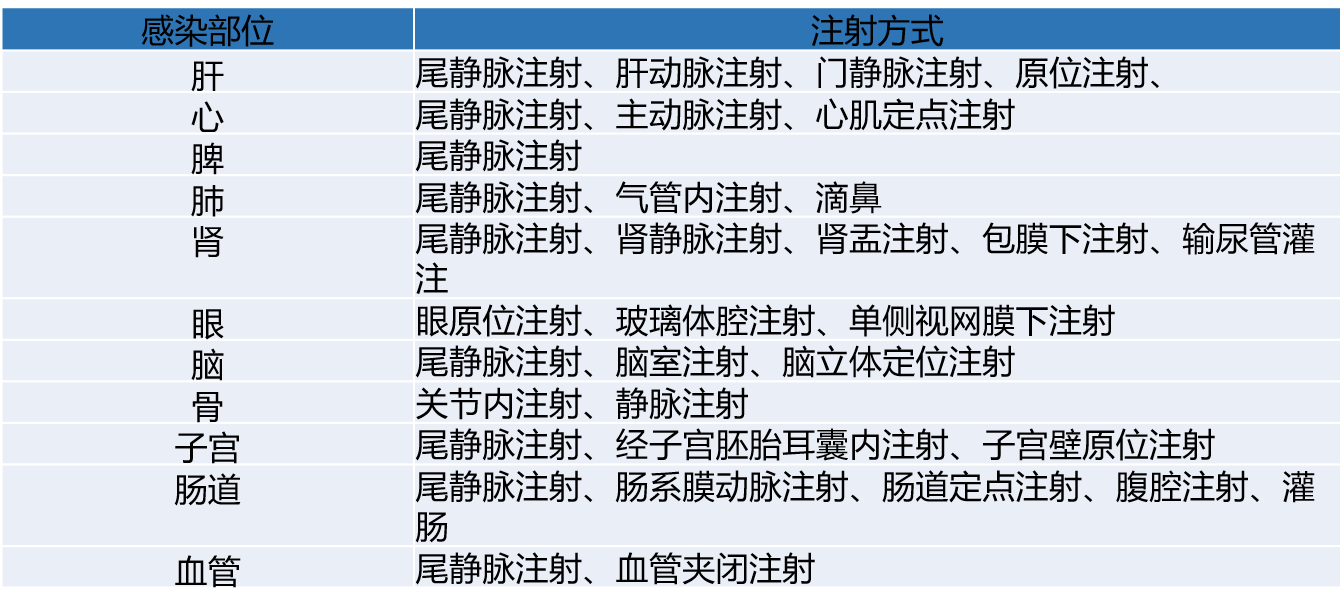
病毒的注射方式大大影响其感染效率,常见的注射方式有:尾静脉注射、腹腔注射、灌肠、脑立体定位注射、原位注射等等。可以通过选择合适的注射方式来实现组织特异性基因调控,对于特定部位,通常采用局部原位注射的方式,比如脑立体定位注射、肌肉定点注射、肝实质注射、心肌原位注射、眼原为注射、关节内注射等。
常见部位注射方式可以参考下表:
2如何选择启动子
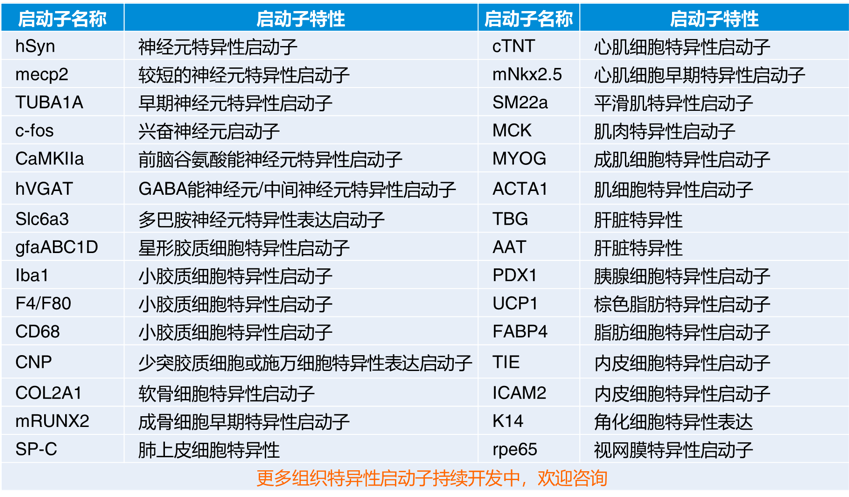
组织特异性启动子通常由特定细胞专一表达基因的启动子鉴定得来的,因此组织特异性启动子种类较多,且细胞特异性更好。根据自己的细胞类型或组织,可以选择特异性启动子,没有特异性启动子的可以用常规启动子。
目前已报道的组织特异性启动子种类繁多,吉凯基因已累积开发出数十种针对不同组织、细胞的特异性启动子。根据针对的细胞类型,靶向器官类型,选择适合的启动子,具体选择可参考下表:
3那么多血清型该选择哪个呢?
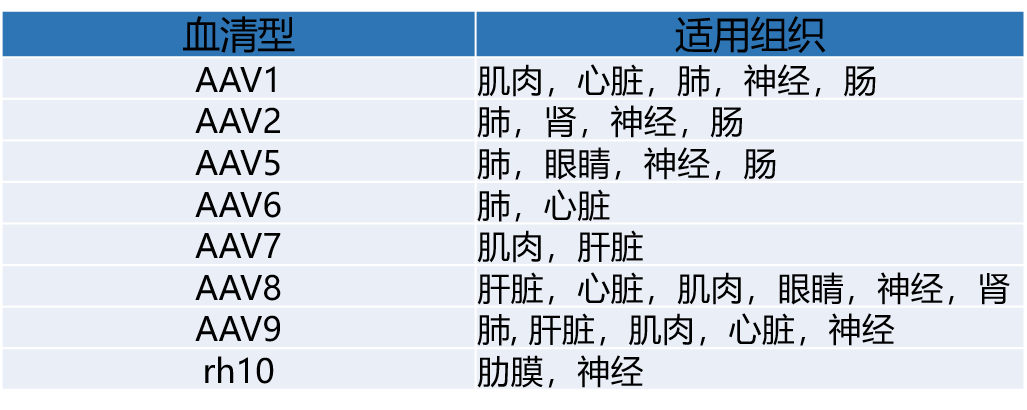
AAV可分为12种血清型(AAV-1~AAV-12)和100多种变异体。血清型的一些位点突变后特异性提高;不同血清型的AAV之间也可以杂交,杂交后的AAV会兼有杂合双方的特点,因此,更多的AAV亚型顺势诞生。
可通过查阅文献,参考前人研究中哪种血清型更合适;如果还不确定选择哪种血清型,可尝试使用AAV试用装进行预实验,通过比较不同血清型对目标组织的感染效果,摸索最佳实验条件(注射方法、注射位点、病毒用量等),以便获得更理想的结果。
吉凯基因持续开发适用于不同组织或细胞的特异性血清型,目前已开发出多种特异性血清型,目前客户使用效果反馈均比较好,具体见下表:
4 病毒注射剂量及检测时间
表达效果与注射剂量有一定的相关性,但注射剂量过大时会对肝脏造成损害。小鼠尾静脉注射用量大,注射体积一般在100-200ul,小范围局部注射或原位注射用量少。
AAV在感染后需要较长的时间来表达外源基因,一般7-14天开始表达,细胞分裂不旺盛的部位会需要更长时间表达。因此感染AAV后建议至少 1 周后再做检测。在体内表达一般在3-4周可以达到高峰,这个时间检测效果会较好。
5 怎么稀释病毒?
稀释病毒产品的等渗溶液没有其他特殊要求,常规动物试验用的等渗溶液即可,如 PBS、生理盐水等。
用完后怎么处理?
对 AAV 最有效的消毒剂是新鲜配制的 1% 次**钠溶液,将 84 消毒液原液加水稀释,浸泡 15 min 可以达到消毒目的。
其他的处理方式包括用 2% 戊二醛溶液或是 0.25% SDS 溶液。
也可以 121℃ 高温消毒 1 小时。
腺相关病毒是动物实验常用的病毒载体,使用特异性启动子靶向转录能力结合AAV血清型靶向感染能力,可实现更精准、高效的基因操作。目前已被广泛应用于神经、肌肉、骨骼、心血管、眼科、肝脏、肾脏、脂肪、胰腺等多个研究领域。
