

发表日期:2022 年 10 月 4 日
客户单位:南方医科大学
研究方法:m6A MeRIP-seq、RIP-seq 、co-IP 、蛋白质谱、LC-MS/MS 核酸修饰整体水平检测、qPCR等
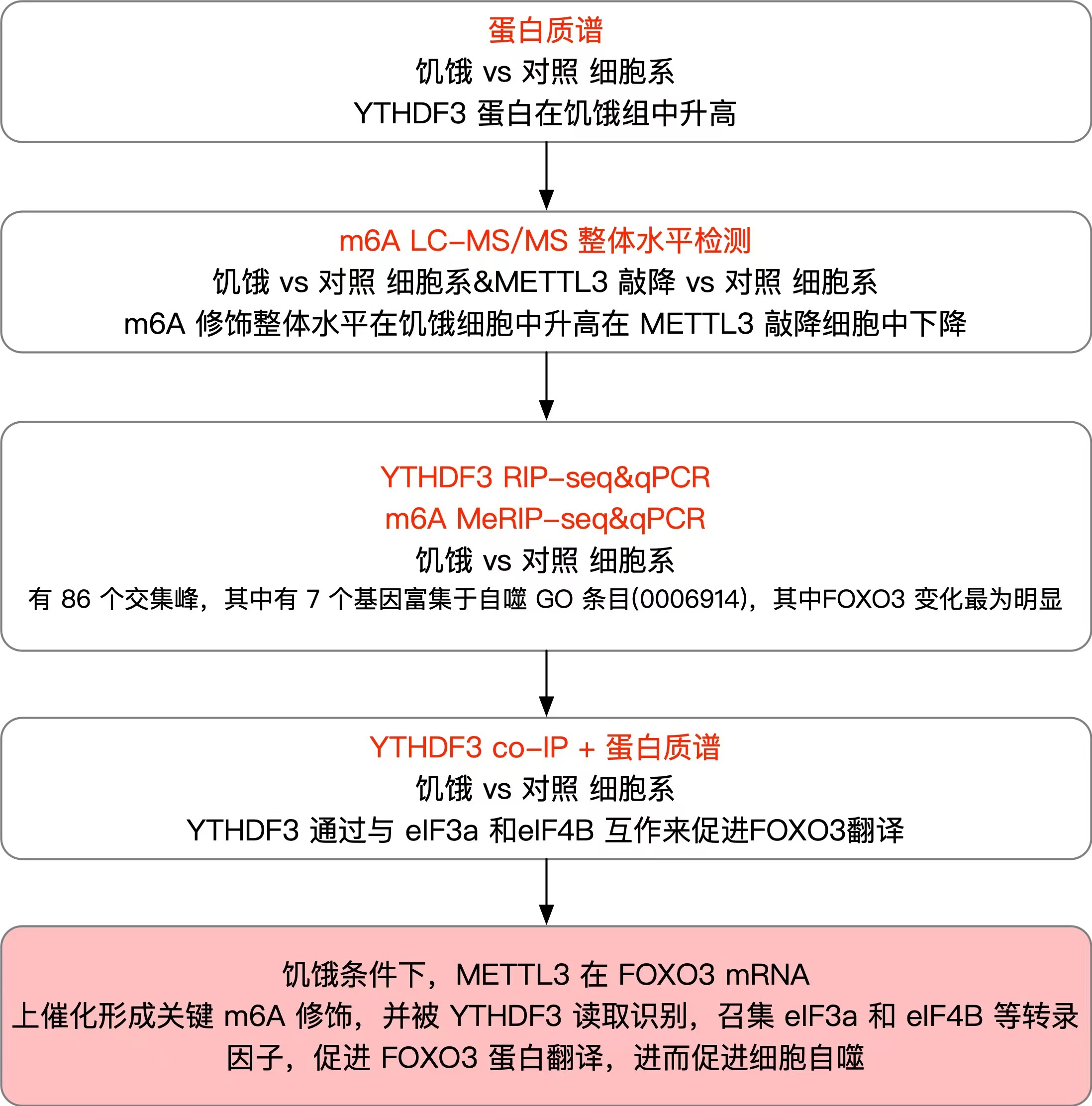
1、YTHDF3 的上调是自噬诱导的必要条件
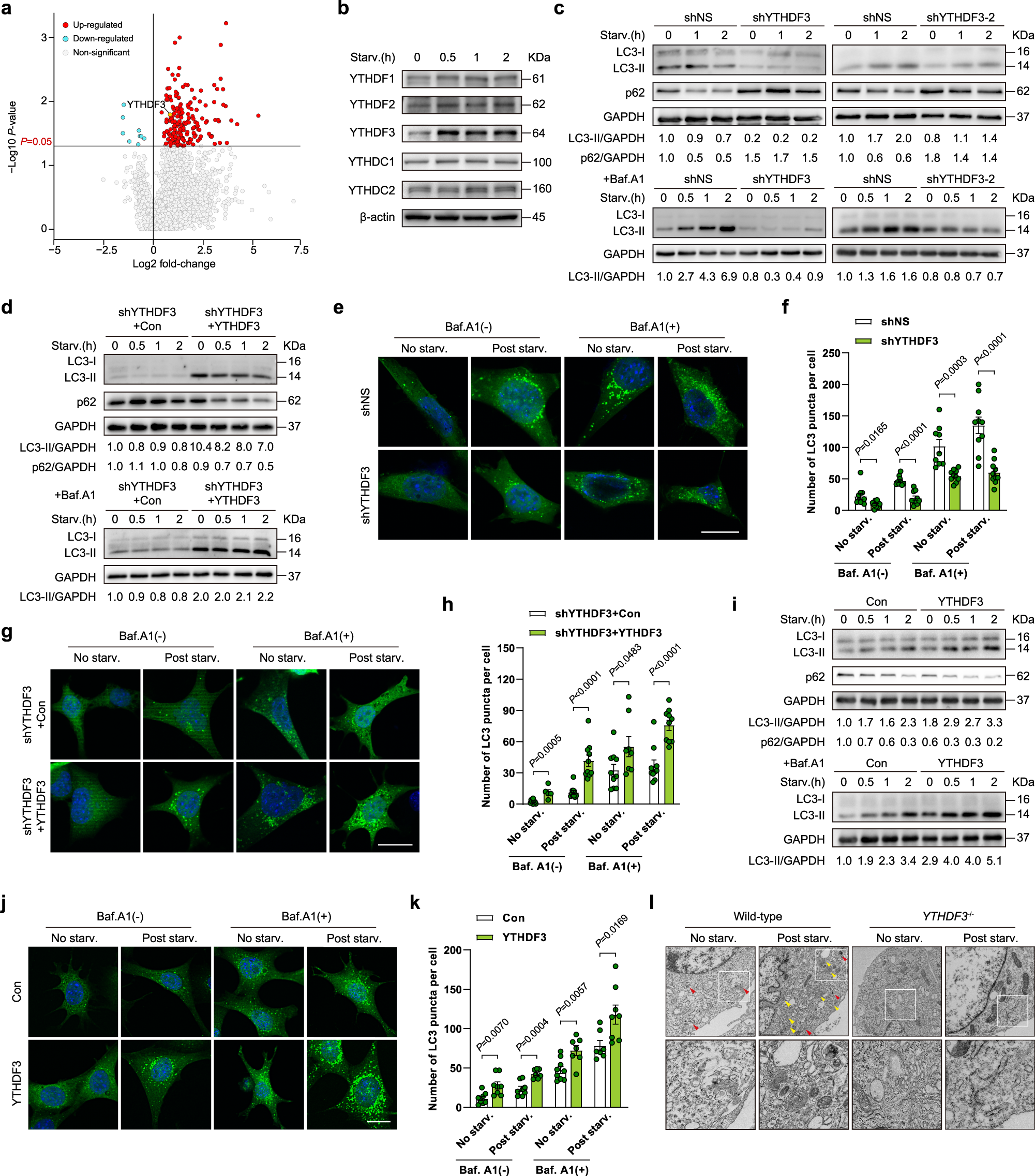
作者通过蛋白质谱实验发现,在低营养饥饿处理的小鼠胚胎成纤维细胞系当中,YTHDF3 这个 m6A Reader 蛋白的水平显著升高。为了检验 YTHDF3 对于自噬的作用,作者设计了 YTHDF3 敲降的细胞系,发现自噬标志蛋白 LC3-II 在 YTHDF3 敲降细胞系饥饿处理后下降,但自噬溶酶体中本来应该被消化的蛋白 p62 却在 YTHDF3 敲降细胞系饥饿处理后上升,说明 YTHDF3 敲降降低了自噬流(autophagy flux)现象。如果在 YTHDF3 敲降细胞中使用载体复原 YTHDF3,则 LC3-II 蛋白浓度升高,而 p62 蛋白则逐渐被消化。如果过表达 YTHDF3,则进一步升高 LC3-II、降低 p62 蛋白的水平。作者还使用 CRISPR/Cas9 系统构建了 YTHDF3 完全敲除的纯合子小鼠胚胎,荧光显微镜观察发现细胞中自噬小体和自噬溶酶体的数目明显减少。综上所述,作者认为 YTHDF3 的上调对于饥饿处理条件下的自噬诱导是不可或缺的。
2、YTHDF3 需要 METTL3 介导的 RNA m6A 修饰来促进自噬作用
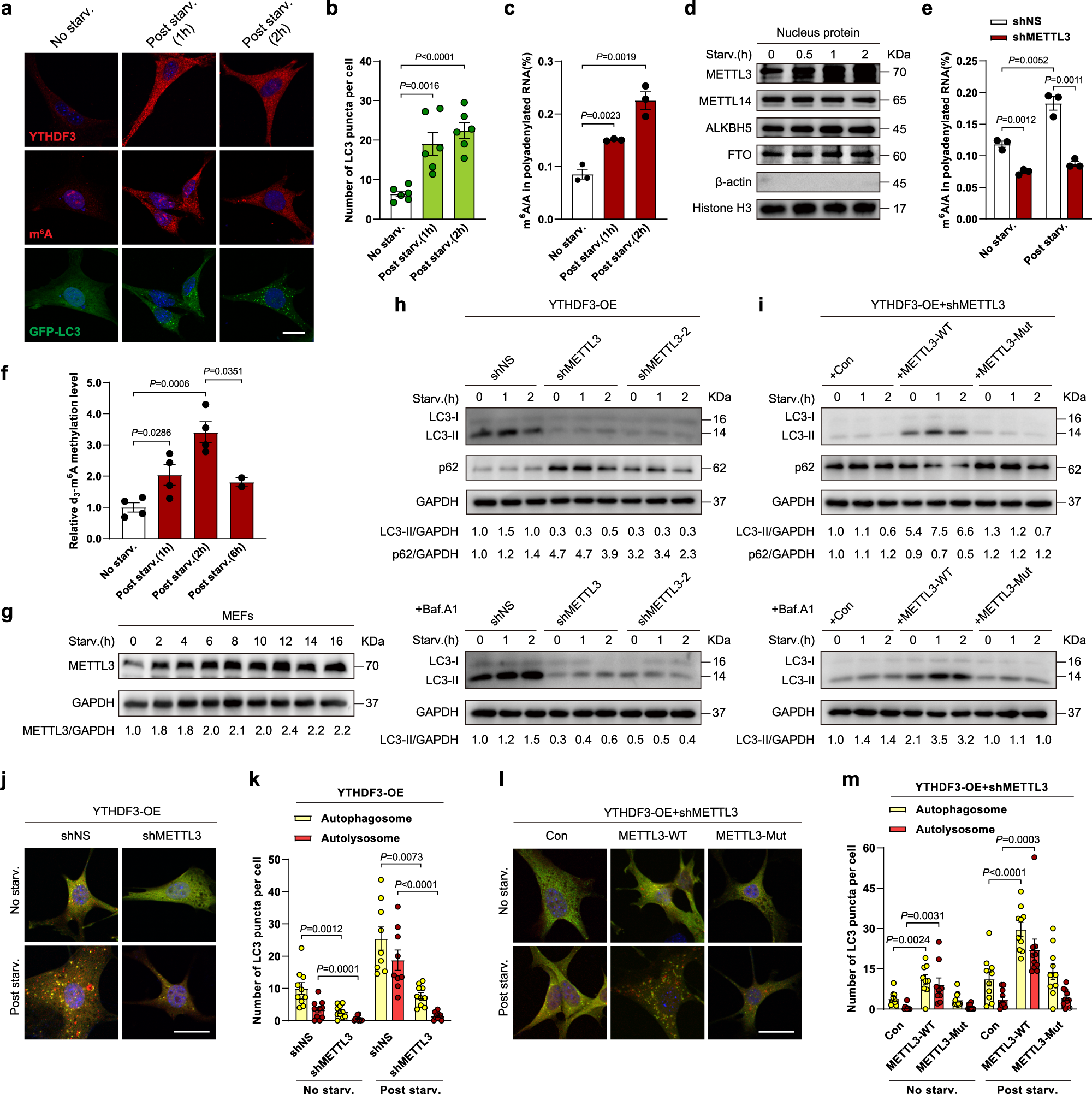
由于 YTHDF3 是一个 m6A Reader 蛋白,作者因此假设 YTHDF3 可能通过 m6A 来促进自噬作用。通过LC-MS/MS 检验 m6A 的整体水平,作者发现饥饿处理后细胞中 mRNA 的 m6A 整体水平升高。通过 Western Blot 检测 m6A 经典 Writters 和 Erasers 的蛋白质水平,作者发现饥饿处理可以显著提升 m6A Writter 蛋白 METTL3 的水平。作者于是设计 METTL3 敲降细胞系,通过LC-MS/MS 检验 m6A 的整体水平,发现 METTL3 敲降后细胞中 mRNA 的 m6A 整体水平下降。为了检测饥饿处理条件下细胞中 METTL3 蛋白的活性,作者在小鼠胚胎成纤维细胞中构建了 METTL3 FLAG 标记融合蛋白,并使用分离得到的 METTL3 FLAG 标记融合蛋白在氘(deuterium)同位素标记的 d3-SAM 作为甲基供体的体外环境下催化含有 RRACH 保守基序(motif)的 RNA 探针发生 m6A 甲基化修饰。结果显示:饥饿细胞中分离得到的 METTL3 蛋白比对照组细胞来源的 METTL3 蛋白对体外 RNA 探针实现了更高比例的 d3-m6A 修饰,说明饥饿处理可以提升 METTL3 蛋白的 m6A 修饰能力。作者因此怀疑 METTL3 介导的 m6A 修饰可能对于 YTHDF3 促进自噬作用至关重要。为了验证这一假设,作者在 YTHDF3 过表达的细胞中敲降 METTL3,结果发现饥饿诱导的 LC3-II 积累和 p62 降解现象均得到了显著的减弱。在饥饿处理的 YTHDF3 过表达细胞中,METTL3 的敲降可导致自噬小体和自噬溶酶体的减少。在此基础上,使用野生型 METTL3 基因质粒转染可以在 LC3-II 蛋白水平上提升自噬作用,但使用无催化活性的突变型 METTL3 基因质粒转染则起不到复原的效果。综上所述,YTHDF3 需要 METTL3 介导的 RNA m6A 修饰来促进自噬作用。
3、饥饿条件下,受抑制的 RPS27a-METTL3 结合关系起到了稳定 METTL3 蛋白的作用
接着,作者进一步探究 METTL3 的 mRNA 水平上是否在饥饿条件下受到了调控。qRT-PCR 结果显示,随着饥饿处理时间的增加,METTL3 的 mRNA 水平也缓慢增加。然而,METTL3 的 mRNA 稳定性在饥饿组和对照组细胞中并无显著差异,说明饥饿对于 METTL3 的调节作用主要并非发生在 mRNA 水平,而是在蛋白质水平:在蛋白酶体抑制剂处理下,饥饿组和对照组细胞中 METTL3 的蛋白质水平几乎一致;而在蛋白合成抑制剂处理下,饥饿组中的 METTL3 蛋白质水平就明显高于对照组;在饥饿组中,METTL3 蛋白的泛素化水平也显著降低。为了探究 METTL3 蛋白的泛素化机制,作者构建了 METTL3 FLAG 标记融合蛋白,并针对这个融合蛋白进行了co-IP 蛋白质谱实验,发现了多个泛素化相关蛋白与 METTL3 蛋白存在结合。根据以往文献报道,作者选取了其中一部分蛋白进行进一步研究,其中 RPS27a 蛋白与 METTL3 的结合受到饥饿处理的损害,但饥饿处理并不会降低 RPS27a 本身的蛋白水平。通过针对 RPS27a 的 miRNA 干扰,发现 METTL3 蛋白在 siRPS27a 的处理条件下得到上调。综上所述,RPS27a 是一个与 METTL3 蛋白结合并促进其泛素化降解的蛋白,在饥饿条件下,受抑制的 RPS27a-METTL3 结合关系起到了稳定 METTL3 蛋白的作用。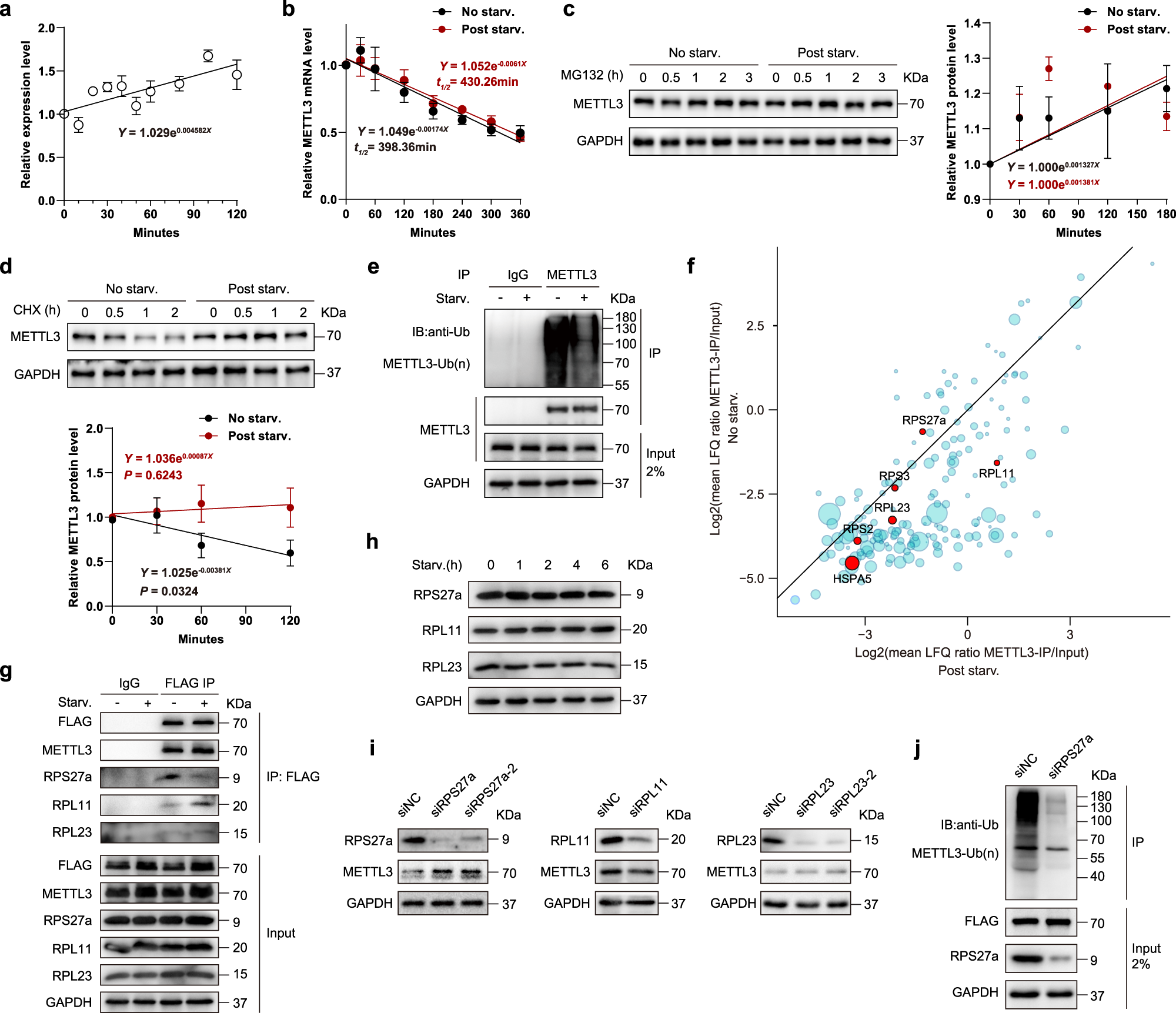
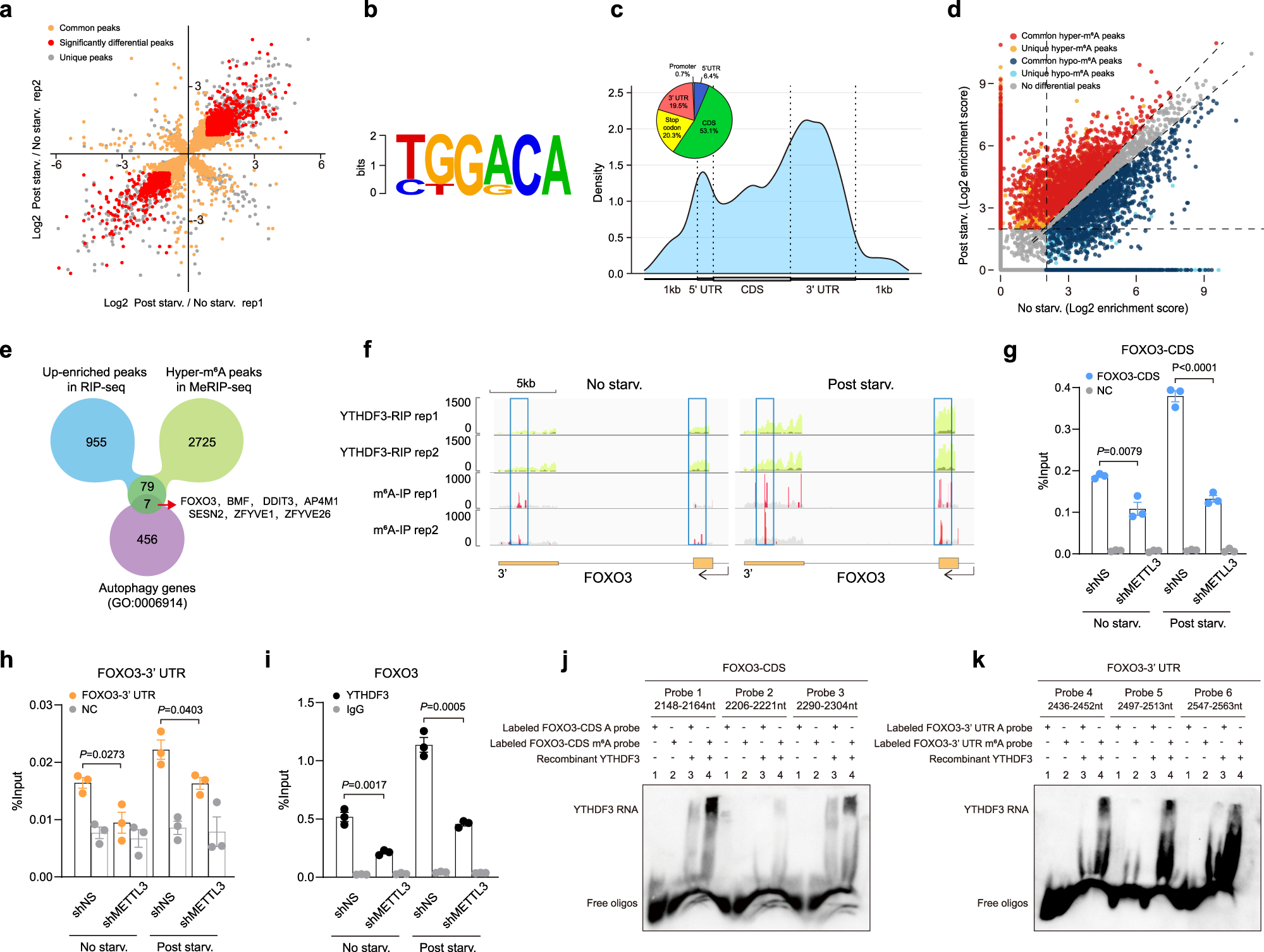
4、YTHDF3 识别 FOXO3 mRNA 上在饥饿条件下诱导产生的 m6A 修饰
针对 YTHDF3 蛋白,作者进行了两次独立的RIP-seq 实验,在饥饿组中分别发现了 4881 和 5013 个 YTHDF3 结合峰,在对照组中分别发现了 2997 和 2865 个 YTHDF3 结合峰。通过将上述两个生物学重复中检测到的转录本取交集,作者发现了饥饿条件下 3424 个 YTHDF3 结合上调的转录本和 1814 个 YTHDF3 结合下调的转录本,其中有 1041 个 YTHDF3 显著结合上调的转录本和 535 个 YTHDF3 显著结合下调的转录本(以 fold change 绝对值 1.8 为阈值,定义“显著结合上/下调”)。YTHDF3 结合位点呈现出“GGAC”的特征 motif。这些结合点大多位于蛋白质编码区序列(CDS)和 3′UTR 当中,特别是集中于终止密码子附近。以上这些特征与以往文献中报道的 m6A 修饰峰的特征相似,因此作者认为 YTHDF3 结合的这些区域主要是发生了 m6A 修饰的区域。
作者随后对饥饿处理的细胞和对照组细胞进行了 m6A MeRIP-seq,发现了饥饿组中 2811 个峰的 m6A 甲基化程度上升,2552 个峰的 m6A 甲基化程度上升。为了寻找 YTHDF3 的 m6A 靶标,作者将 YTHDF3 RIP-seq 当中饥饿组的富集峰与 m6A MeRIP 测序当中饥饿组上调的峰取交集,得到了 86 个交集峰。其中,有 7 个基因富集到了 GO 条目 0006914 当中,也就是自噬(Autophagy)通路,它们包括了:FOXO3, BMF, DDIT3, AP4M1, SESN2, ZFYVE1, 和 ZFYVE26 这 7 个基因。通过针对 YTHDF3 的 RIP-qPCR,这 7 个基因当中的 6 个都被验证了与 YTHDF3 蛋白在饥饿处理条件下的结合,并且 FOXO3 在 RIP-qPCR 中的富集尤其明显。根据早前的文献报道,FOXO3 是一个参与自噬的重要转录因子。进一步的免疫印迹实验显示,敲降 YTHDF3 可以降低 FOXO3 和 ZFYVE1 的表达,而过表达 YTHDF3 则会起到反效果。作者额外选取了自噬相关的几个经典基因进行免疫印迹实验,但发现它们的表达都和 YTHDF3 无关。早前的文献报道显示,ZFYVE1 基因并不抑制自噬作用,因此作者将其也排除了,仅留下 FOXO3 基因进行后续的研究。YTHDF3 RIP-seq 以及 m6A MeRIP-seq 实验结果已经显示,在饥饿条件下,FOXO3 基因 mRNA 上的 m6A 修饰峰位于 CDS 和 3'UTR 当中。为了验证 YTHDF3-FOXO3 mRNA 互作依赖于 METTL3 介导的 m6A 修饰,作者在细胞系中敲降了 METTL3,m6A MeRIP-qPCR 结果显示,无论是在 FOXO3 mRNA 的 CDS 还是 3'UTR 区域,都出现了 m6A 修饰水平的下降;YTHDF3 RIP-qPCR 结果则显示,YTHDF3-FOXO3 mRNA 结合升读也下降。作者进一步设计了 YTHDF3 重组蛋白,还设计了生物素标记的带有或不带有 m6A 修饰的 FOXO3 mRNA 的 CDS 区和 3'UTR 区的多种 RNA 探针,进行 EMSA 实验。结果显示,对于 YTHDF3 重组蛋白,无论是对于 CDS 区还是 3'UTR 区,只要是带有 m6A 修饰的探针,EMSA 信号就强;只要是不带 m6A 修饰的探针,EMSA 信号就弱。其中,落在 CDS 区内的两个探针的 EMSA 信号尤其强,其覆盖范围包括了 2158nt, 2151nt, 2163nt 和 2295nt 这几个关键的腺苷酸位点,它们可能帮助 YTHDF3 识别 FOXO3 的终止密码子。总之,上述实验结果证明饥饿条件下 METTL3 介导的 m6A 高甲基化对于 YTHDF3-FOXO3 mRNA 的识别互作是必不可少的。
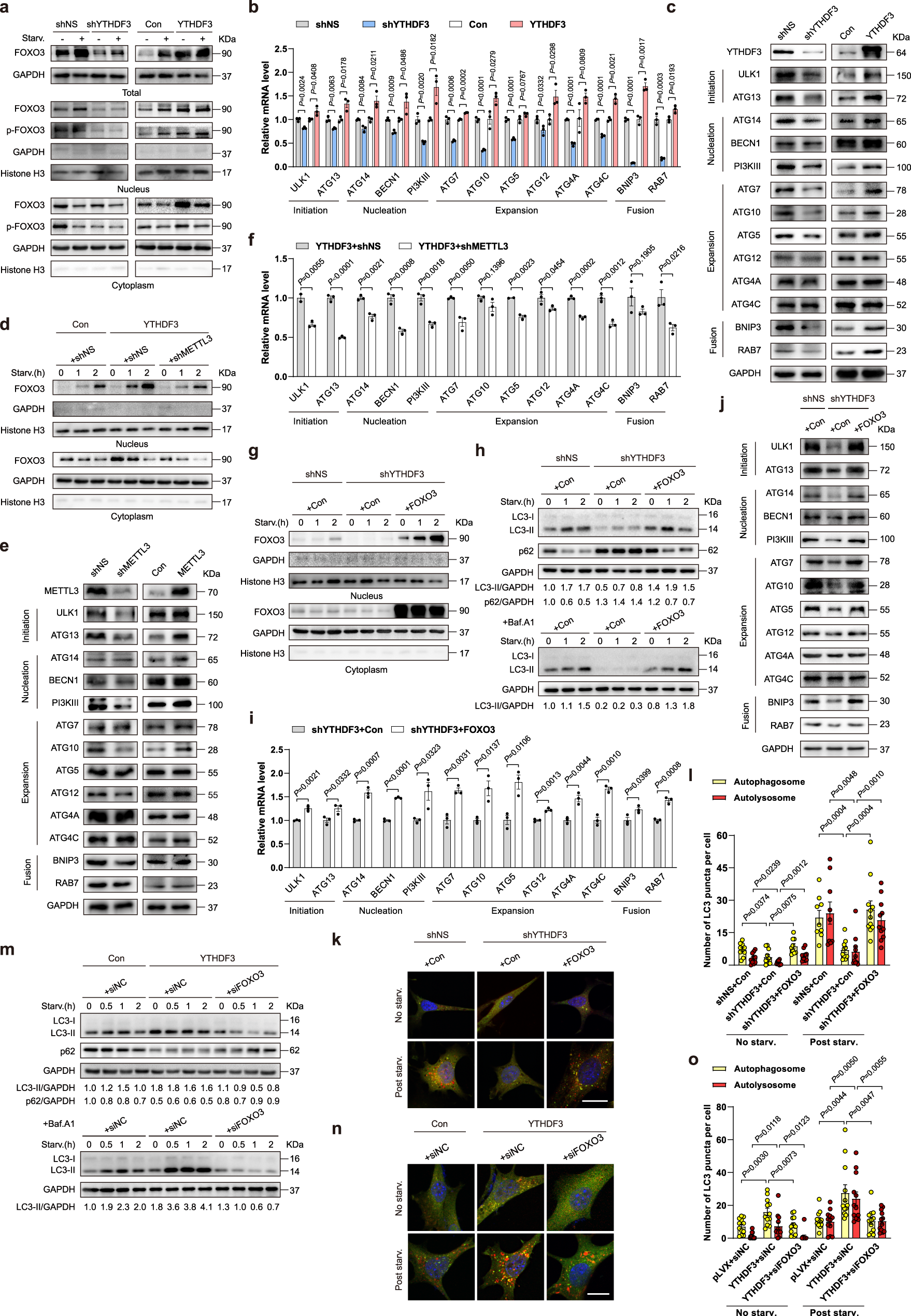
5、YTHDF3 通过 FOXO3 促进自噬
作者敲降 YTHDF3 后,发现 FOXO3 蛋白水平显著降低,而 YTHDF3 过表达,则会使得 FOXO3 蛋白水平显著升高。作者选取了几个与自噬有关的 FOXO3 目标基因,发现这些基因在 YTHDF3 敲降后 mRNA 水平和蛋白水平均下降,而在 YTHDF3 过表达后 mRNA 水平和蛋白水平均上升。METTL3 则是一个大前提因素,如果敲降 METTL3,那么即使是在 YTHDF3 过表达的饥饿细胞中,FOXO3 的蛋白表达水平升高程度也会显著减弱。对于大多数 FOXO3 目标基因(包括 ULK1,ATG13,ATG14 等),在 METTL3 敲降后它们的蛋白表达降低,而在 METTL3 过表达后他们的蛋白表达增强。这些数据进一步表明,YTHDF3 以 METTL3 依赖的方式,调节了 FOXO3的表达,并间接调节 FOXO3 目标基因的表达,从而影响自噬作用。作者还在 YTHFD3 敲降细胞系中进行了 FOXO3 回补实验,发现 FOXO3 蛋白水平得以复原,并且自噬标志蛋白 LC3-II 的表达也得到复原,而自噬溶酶体中的蛋白 p62 则在 FOXO3 回补后逐渐被消化掉。类似的结果(自噬小体和自噬溶酶体的增加)也在荧光显微镜实验中发现,进一步印证了 YTHDF3 通过 FOXO3 促进自噬。
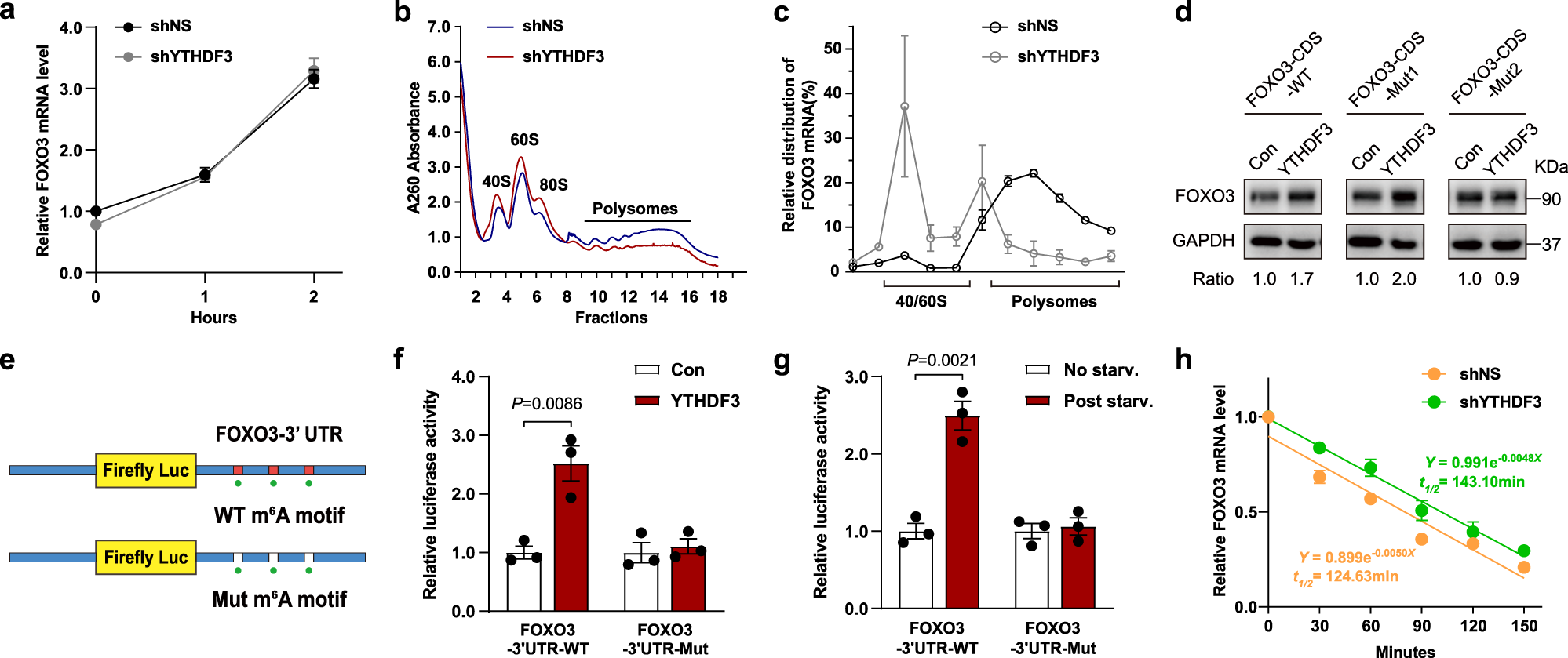
6、YTHDF3 促进 FOXO3 的翻译,但是不影响 FOXO3 mRNA 的稳定性
早前的报道显示,YTHDF3 可能通过与核糖体互作而促进 RNA 翻译,也可能通过与 YTHDF2 互作而降低 mRNA 稳定性。作者发现,YTHDF3 敲降细胞相比于对照组而言,FOXO3 的 mRNA 水平并不发生变化。即使用转录抑制剂 Act D 处理,YTHDF3 敲降细胞与对照组相比,FOXO3 的 mRNA 水平同样没有明显差异。因此作者猜测 YTHDF3 更可能通过促进 FOXO3 翻译来起作用,而非影响 FOXO3 的 mRNA 稳定性。于是作者进行了多聚核糖体分析(Polysome profiling)来检测 FOXO3 的翻译,发现在 YTHDF3 敲降组中,FOXO3 的 mRNA 分布在多聚核糖体中的水平要低于对照组,说明 FOXO3 的蛋白翻译活跃程度下降。作者随后进行了点突变实验,来验证 FOXO3 mRNA CDS 区上 m6A 峰中的 m6A 修饰对 YTHDF3 识别的作用。作者将 FOXO3 CDS 区上最接近终止密码子的 m6A 修饰经典 motif RRACH 上的腺苷(A)突变为了胸苷(T),发现对于突变型的 FOXO3 mRNA 而言,YTHDF3 不能再起到促进 FOXO3 翻译的作用。这说明 FOXO3 CDS 区上的最接近终止密码子的 m6A 修饰是 YTHDF3 的识别对象。作者也针对 FOXO3 mRNA 上 3'UTR 上的 m6A 修饰做了类似的点突变工作,并通过荧光素酶报告实验验证了 3'UTR 上的 m6A 修饰与 YTHDF3 的互作。
7、YTHDF3 通过与 eIF3a 和 eIF4B 互作来促进 FOXO3 翻译
作者针对 YTHDF3 蛋白进行了 co-IP 蛋白质谱检测,发现了多种与 YTHDF3 结合的转录因子蛋白质。其中,在饥饿处理的细胞当中,eIF3a 和 eIF4B 是与 YTHDF3 结合程度最高的两个转录因子。针对不同的核糖体组分的 Western Blot 实验以及分子对接(docking)生物信息学分析预测都显示,YTHDF3 蛋白与 eIF3a 和 eIF4B 很可能存在分子互作。作者还针对 YTHDF3 蛋白进行了 co-IP 实验,结果显示 YTHDF3 蛋白与 eIF3a 和 eIF4B 确实存在结合。并且,YTHDF3 蛋白与 eIF3a 和 eIF4B 的结合还不依赖于任何 RNA,RNase A 处理并不影响 co-IP 中发现的 YTHDF3 蛋白与 eIF3a 和 eIF4B 的结合。然而,倘若敲降 eIF3a 或 eIF4B 的 mRNA,会降低 FOXO3 的蛋白水平,按时可能抑制了 FOXO3 的蛋白翻译过程。综上所属,YTHDF3 可能通过与 eIF3a 和 eIF4B 互作来促进 FOXO3 翻译。此外,针对 YTHDF3 的 co-IP 蛋白质谱还发现,PABP1 和 eIF4G2 这些在抗病毒先天免疫当中发挥功能的蛋白也与 YTHDF3 存在互作,然而它们之间的互作在饥饿处理后减弱了,而非像 eIF3a 和 eIF4B 那样在饥饿处理后与 YTHDF3 结合增强。这说明不同转录因子与 YTHDF3 的结合,在饥饿条件下会发生不同的调控。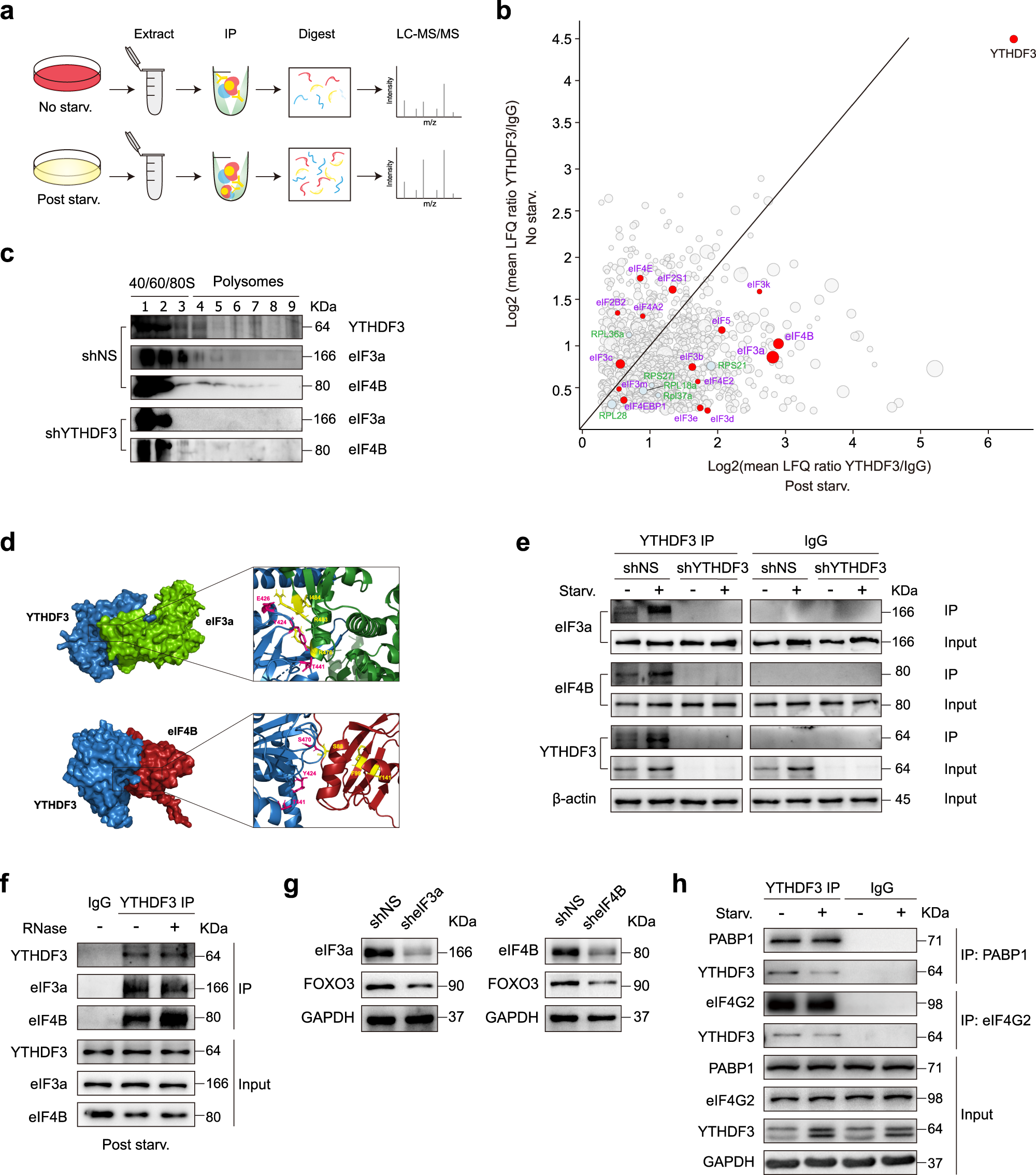
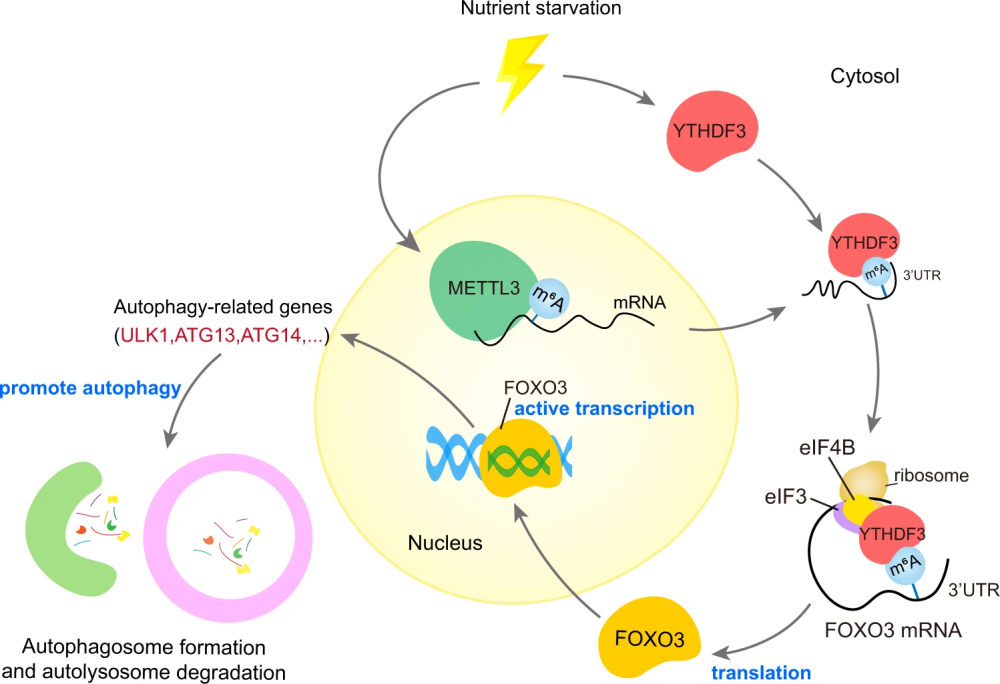
总结而言,在营养饥饿条件下,m6A Reader 蛋白 YTHDF3 和 m6A Writter 蛋白 METTL3 发生上调。METTL3 在 FOXO3 mRNA 上终止密码子前后 CDS 区域 和 3'UTR 区域催化形成了一些关键的 m6A 修饰位点,YTHDF3 则负责识别这些 m6A 修饰,并召集 eIF3a 和 eIF4B,从而促进 FOXO3 的蛋白翻译。大量翻译产生的 FOXO3 蛋白随后进入细胞核,促进一系列目标基因的转录,从而间接起到促进自噬的作用。
云序生物m6A修饰研究五大模块
01 m6A RNA修饰测序
m6A RNA修饰测序(m6A-meRIP-seq)
对m6A RNA甲基化,目前最流行的检测手段为m6A-MeRIP-Seq技术,适用于m6A RNA甲基化谱研究,快速筛选m6A RNA甲基化靶基因。云序可提供mRNA和多种非编码RNA的m6A测序:
- m6A 全转录组测序(涵盖mRNA,LncRNA,circRNA)
- m6A LncRNA测序(涵盖LncRNA和mRNA)
- m6A Pri-miRNA测序(涵盖Pri-miRNA和mRNA)
- m6A mRNA测序
- m6A miRNA测序
LC-MS/MS检测整体RNA修饰水平
精准高效,可以实现一次检测,9类修饰水平检测,一步到位。
比色法检测整体RNA修饰水平
快速检测m6A整体甲基化水平
03 m6A RNA修饰上游酶的筛选
m6A RNA修饰相关酶PCR芯片
寻找上游直接调控m6A RNA甲基化的甲基转移酶。
04 m6A RNA修饰靶基因验证
MeRIP-qPCR/GenSeq® MeRIP试剂盒
云序提供各类不同修饰的meRIP-qPCR服务以及销售GenSeq® MeRIP试剂盒,可针对mRNA,lncRNA,环状RNA等不同类型的RNA分子进行检测,低通量验证RNA修饰靶基因表达水平。05 机制互作研究
5.1 RIP-seq/qPCR/GenSeq® RIP试剂盒
优势一:云序累计支持客户发表 83 +篇RNA修饰SCI论文,合计影响因子 795 +
优势二:累计完成数千例 RNA甲基化测序样本,全面覆盖医口、农口等各类样本。
优势三:全面检测mRNA和各类非编码RNA(circRNA,lncRNA,Pri-miRNA等)。
优势四:提供m6A一站式服务:m6A整体水平检测、m6A测序、MeRIP-qPCR验证、RIP和
地 址: 上海市松江区莘砖公路518号24号楼4楼 联系人: 戴小姐 电 话: 021-64878766 传 真: 021-64878766 Email:market@cloud-seq.com.cn;liuqingqing@cloud-seq.com.cn
杨宝峰院士团队RNA修饰又一成果 | 云序ac4C acRIP-seq助力揭示心脏I/R损伤的作用机制
(2024-12-03T00:00 浏览数:16021)
杨宝峰院士团队最新成果 | 云序助力揭示RNA修饰m7G调控心肌肥厚的机制研究
(2024-11-13T00:00 浏览数:17233)
Nature子刊| 重磅综述!一文总结「m6A修饰非编码RNAs」在各类肿瘤中的调控机制及作用
(暂无发布时间 浏览数:12982)
研究速览-eccDNA 2023年最新进展大放送!
(暂无发布时间 浏览数:15426)
云序生物MeRIP-qPCR技术干货
(暂无发布时间 浏览数:15172)
技术干货| “eccDNA碱基序列的获取及引物设计”方法教程
(暂无发布时间 浏览数:13933)
云序客户m6A高分文章|揭示组蛋白乙酰化与m6A修饰在眼部黑色素瘤发生中的共同作用机制
(暂无发布时间 浏览数:7522)
Nat Biotechnol IF=47 | BID-seq:一种基于单碱基分辨率的假尿嘧啶(Ψ)修饰定量测序检测方法
(暂无发布时间 浏览数:7473)
北大伊成器团队Nature Reviews重磅发文:非m6A热门修饰调控与功能一文速览!
(暂无发布时间 浏览数:11762)
用户文章m6A专题|IF=9.8|m6A去甲基化酶ALKBH5缺乏会加重钴致神经退行性损伤
(暂无发布时间 浏览数:7443)
上海云序生物科技有限公司
商家主页
相关咨询
