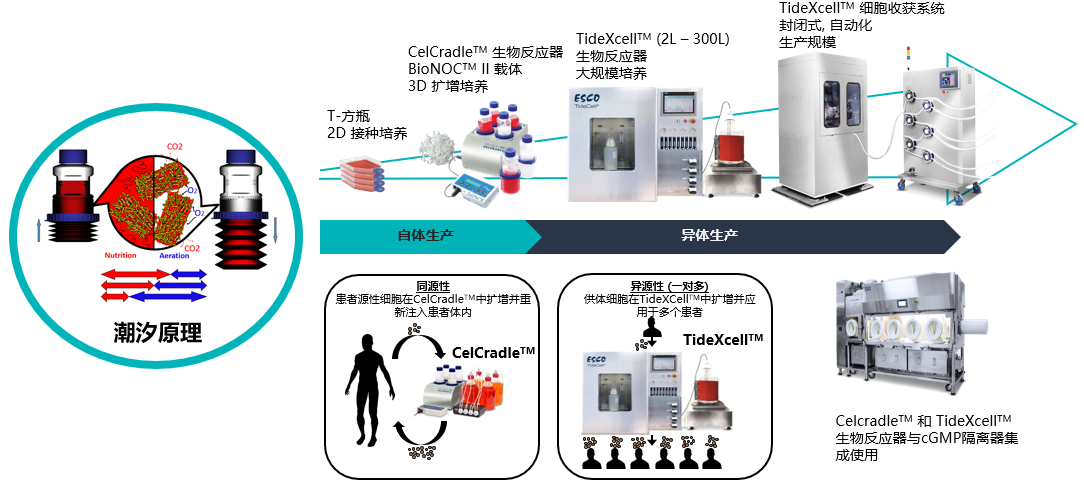
前 言
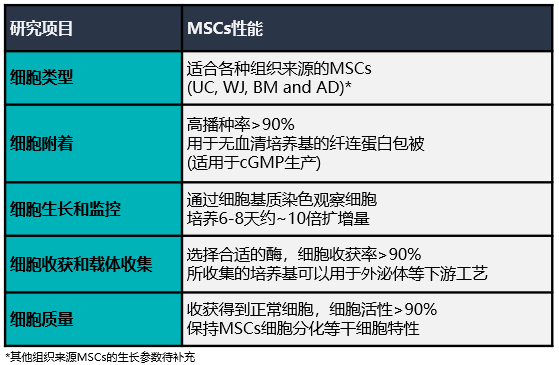
未来的细胞治疗需要大量的间充质干细胞(MSCs),每个剂量从1000万到2亿多个细胞不等。当需要超过5000万个细胞的大剂量使用时,传统的平板培养是不切实际的。而利用生物反应器并结合线性放大、过程控制和自动化,是解决这一需求的主要方法。然而许多生物反应器在MSCs培养方面都面临技术难题,比如如何控制培养基充分混合的同时将剪切力最小化,以及如何从具有高产量和高活性的片状载体中分离得到细胞等诸多难点。
潮汐式生物反应器,利用3D片状载体(BioNOCTM II)建立了一个强大的、可扩展的平台,以满足未来临床治疗的需求。在整个培养期间,监测细胞培养条件,并测量生长过程参数,如葡萄糖消耗量和pH值,以确保适当的放大。同时研究优化干细胞培养系统所需的细胞接种密度、培养基培养条件和改进的生物工艺参数等关键问题。总的来说,Esco将提供过程优化与质量控制以及放大生产过程中的相关标准,以便协助用户将学术或工业研发转化为面向未来的临床试验和商业化销售。

各组织来源MSCs的生长情况
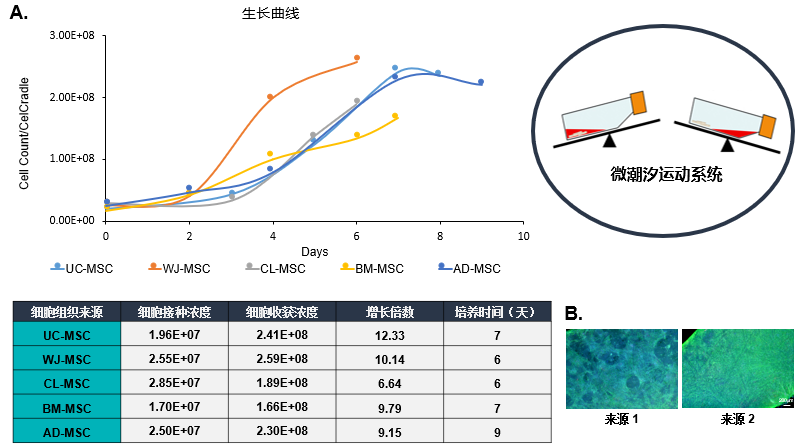
(A)用潮汐式生物反应器系统成功扩增了不同组织来源的MSCs。MSCs的常见组织来源,如脐带间充质干细胞(UC-MSC)、沃顿胶间充质干细胞(WJ-MSC)、骨髓间充质干细胞(BM-MSC)和脂肪间充质干细胞(AD-MSC),在培养后7天内普遍可扩增10倍。上表列出了使用商业细胞来源进行优化的不同组织来源MSCs的接种密度。
(B)将同类型(相同组织来源)但细胞来源不同的MSCs,从低播种密度进行扩增能力测试。结果显示,来源2的BM-MSCs与来源1的BM-MSCs生长情况存在明显差异,因此在进行线性放大扩增之前,需要对每个来源MSCs进行播种密度、培养基变化规律等参数进行优化。
MSCs在不同培养基中的扩增情况
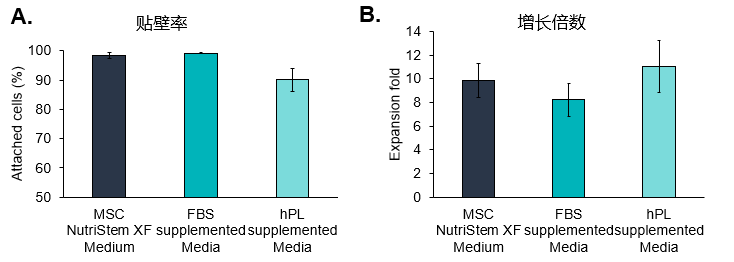
(A) 将UC-MSCs接种于含血清代替物(hPL)的培养基中,观察到其对载体的贴壁效率较低。
(B) 尽管观察到的附着效率较低,但使用血清代替物补充培养基,使不同组织来源MSCs的细胞扩增倍数增大。
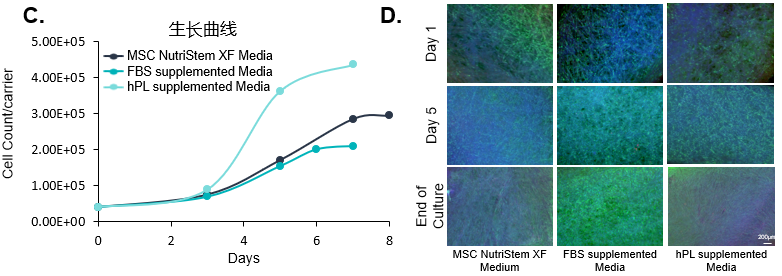
(C) 在将UC-MSCs接种到BioNOCTM II载体之前,对不同培养基类型培养的细胞进行2次以上传代,以监测其增殖速率。结果显示含血清代替物(hPL)培养基培养的细胞增长最快。
(D) 荧光图像显示细胞在培养期间在载体上的扩增情况,结果显示含胎牛血清(FBS)培养基的细胞生长较好,含血清代替物(hPL)的次之。综合考量,使用含血清代替物培养基是更优的选择。
绿色:荧光素二乙酸酯(活细胞细胞质)
蓝色:Hoechst 33342(细胞核)
红色:碘化丙啶(死细胞)
细胞收集工艺优化
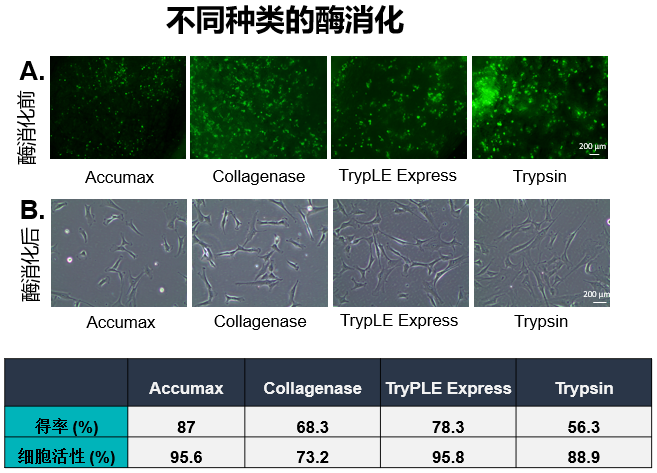
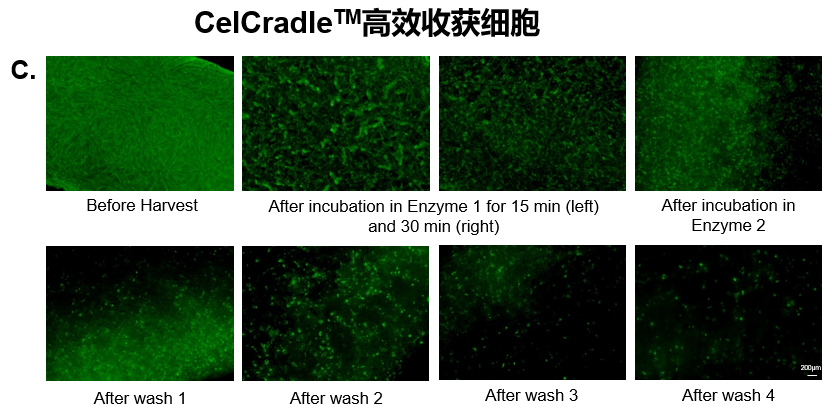
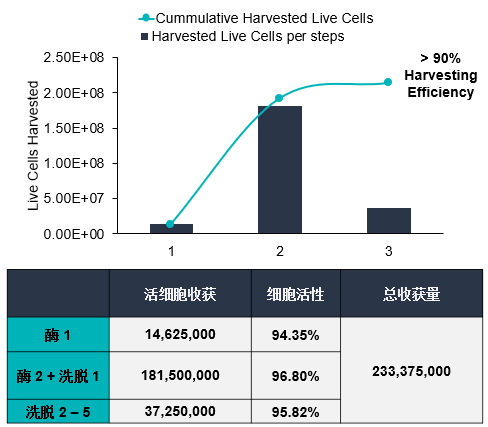
通过优化参数,开发了一种从BioNOCTM II载体高效收获UC-MSCs的方法。在整个实验过程中,使用荧光素二乙酸酯(FDA)对BioNOCTM II载体上的活细胞进行染色。
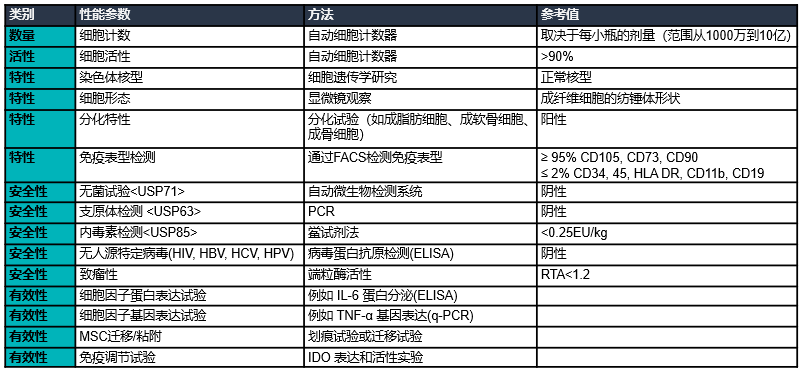
质量控制
结 论
*潮汐式生物反应器是由无菌一次性CelCradleTM细胞培养瓶和波纹管压缩平台组成,可线性放大,且在培养过程中支持取样监测。
*小规模系统支持MSCs早期研发阶段,可以低成本高效率进行参数优化。
*为大批量生产MSCs提供一个很好的平台。