结直肠癌(CRC)和肝细胞癌(HCC)是癌症中最常见的死亡原因,两种癌症的病因有病毒感染、长期饮酒、吸烟、饮食、肥胖和糖尿病等,其中肠道菌群结构的病理性变化所导致的肠道炎症是HCC和CRC的共同发病因素。而不同疾病的病因和环境的差异,使患者的肠道菌群也发生着特异的改变。本文综述了HCC和CRC各个阶段(正常-炎症-炎症降低)肠道菌群组成的变化,提出肿瘤发展部分取决于促炎性肿瘤微环境的观点,在HCC和CRC以及不同病因诱发的HCC之间观察到的肠道菌群组成差异表明肿瘤微环境(TME)存在显著差异,相关成果于2020年8月14日发表在《Protein & Cell》期刊上。
HCC和CRC进展
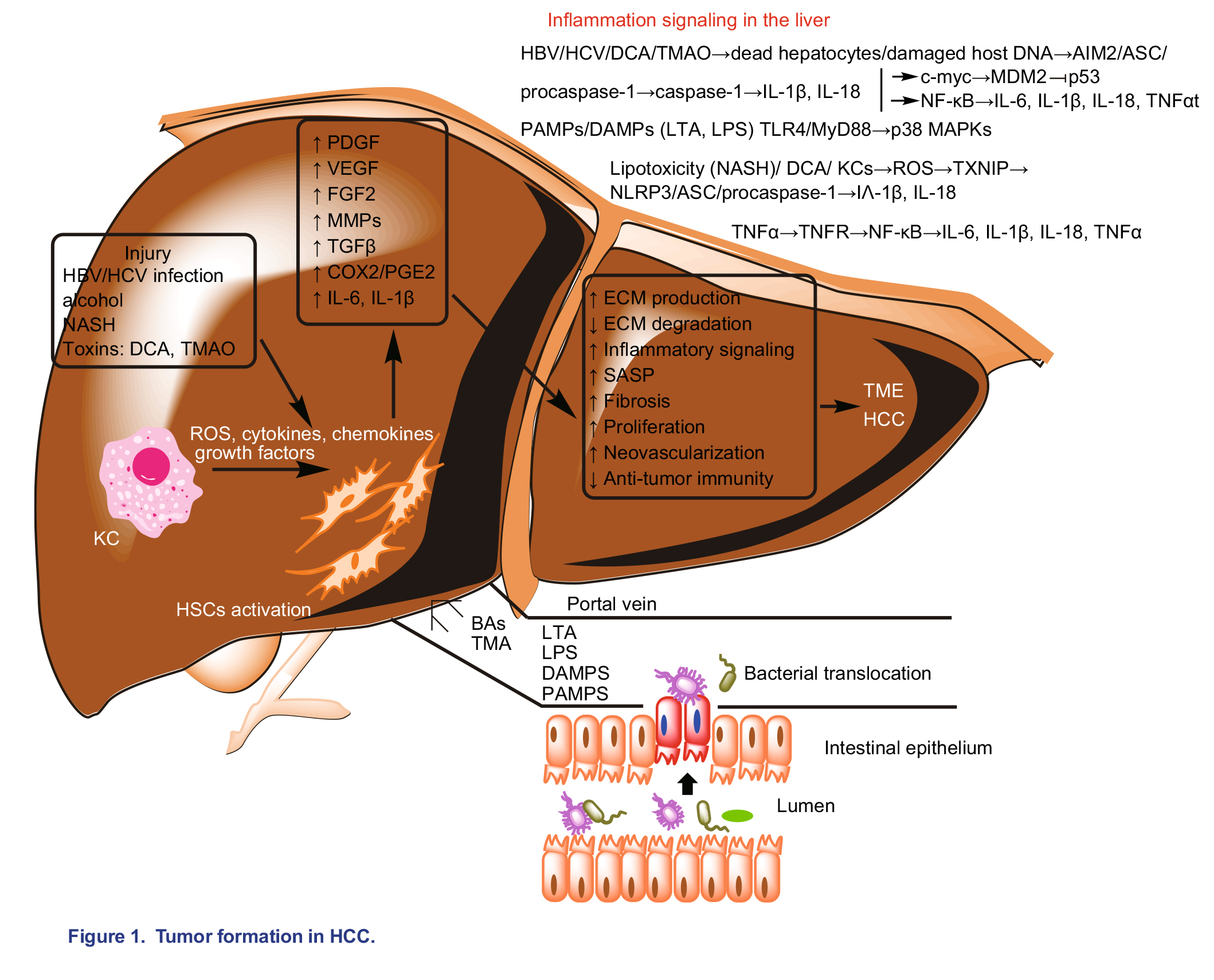
肝癌发生发展涉及慢性肝细胞死亡、炎症和肝组织修复诱导的纤维化等多个阶段。在非病毒性肝癌中,由于高脂饮食、酒精或次级胆汁酸增加,导致慢性肝病(CLD)相关肠屏障功能障碍,使得肠道菌群产物进入肝脏。肠屏障通透性增加导致细菌产物发生易位,这些产物主要为革兰氏阴性菌产生的脂多糖(LPS)和革兰氏阳性菌产生的脂磷壁酸(LTA),结合并激活Toll样受体TLR-4 。激活的TLR-4启动NF-κB炎性信号通路,诱导炎性细胞因子IL-1β和IL-18产生。肝硬化或非酒精性脂肪肝(NASH)诱发的HCC通常与持续的LPS/LTA-TLR-4信号激活有关。肠道菌群产生的刺激胆汁酸脱氧胆酸(DCA)水平升高与NASH相关的HCC有关。炎性信号通路JNK / p38→NF-κB→IL-18/1β→肝星状细胞(HSC)活化增强,ROS升高→纤维化增加,该通路不仅可以被肝脏脂质储存过多引起的脂毒性激活,而且还可能由NASH中DCA引起的DNA损伤激活。NASH也与线粒体功能障碍密切相关,因为肝细胞中脂质蓄积会导致过氧化物酶体增殖激活受体(PPARs)激活增加,从而导致ROS升高,氧化应激增加,细胞死亡和HSC纤维化激活。线粒体来源的ROS也可以诱导炎性细胞因子TGF-β、TNF-α和IL-6的产生。与NASH、肝脏炎症相关的另一种肠道菌群衍生代谢物三甲胺(TMA),来自胆碱代谢,可在肝脏中转化为三甲胺氧化物(TMAO),不仅引起肝细胞损伤,同时导致胆碱缺乏和肝脏脂肪变性,增加肝癌风险。
病毒相关肝癌由乙型或丙型肝炎病毒引起的免疫介导的肝细胞损伤而发生。首先,病毒感染引起肝细胞坏死并通过释放的细胞因子的旁分泌作用激活HSC。其次,活化的Kupffer细胞(KC)和白细胞发生浸润进一步刺激HSC发展为纤维原性成纤维细胞,继而释放细胞因子以刺激包括胶原蛋白I、III、层粘连蛋白和纤维连接蛋白在内的ECM组分过度生产,从而导致ECM生成和降解出现紊乱,发生纤维化。活化的HSC进入衰老阶段成为衰老相关的分泌表型(SASP),分泌促进肿瘤进展的细胞因子(IL-6,IL-8),趋化因子和蛋白酶(基质金属蛋白酶,MMPs),从而重塑ECM并促进炎性反应。
KC是一类常驻肝脏巨噬细胞,可通过吞噬作用以损伤相关分子模式(DAMP)的形式去除微生物碎片,这些微生物碎片主要来源于受损的肝细胞和微生物相关模式(MAMP),例如LPS和肝脏血中的细菌。当KC被炎性细胞因子激活时,它们会分泌更多的炎性细胞因子和趋化因子来影响HSC的激活并通过促进其他类型白细胞的浸润来调节免疫反应。肝脏巨噬细胞可通过对T细胞、B细胞和NK-T细胞的免疫调节作用进行修复。纤维化和炎症消退之间的失衡会导致纤维化增加和肝硬化,从而导致肝癌。图1总结了从炎症到慢性肝病CLD再到肝癌HCC的过程。
与HCC类似,CRC在慢性炎症和修复的微环境中缓慢进展,通过不同病因引起正常肠粘膜的不同畸变。散发性(SCRC)和结肠炎性(CCRC)结直肠癌的组织学以及细胞突变在时间/序列上有所不同。图2总结了散发性和结肠炎性CRC之间的差异性/相似性。结肠炎通常是由细菌或病毒等感染引发,而细菌或病毒感染又会激活免疫应答,从而导致最初的炎症,形成一个长期反复溃疡的循环周期,之后发生非整倍体细胞异常增加而使细胞上皮化。在肠道中,肿瘤相关的骨髓细胞分泌IL-23,影响Th17细胞的极化,随后产生细胞因子IL-17A、IL-21、TNF-α和IL-6,进而在CRC发展中提供促肿瘤的炎症反应。IL-6激活信号转导和转录激活因子3(STAT3)信号通路,进而促进肿瘤生长和抗肿瘤免疫。IL-6还能激活NF-κB信号传导途径,有助于维持炎症并促进肿瘤发生。
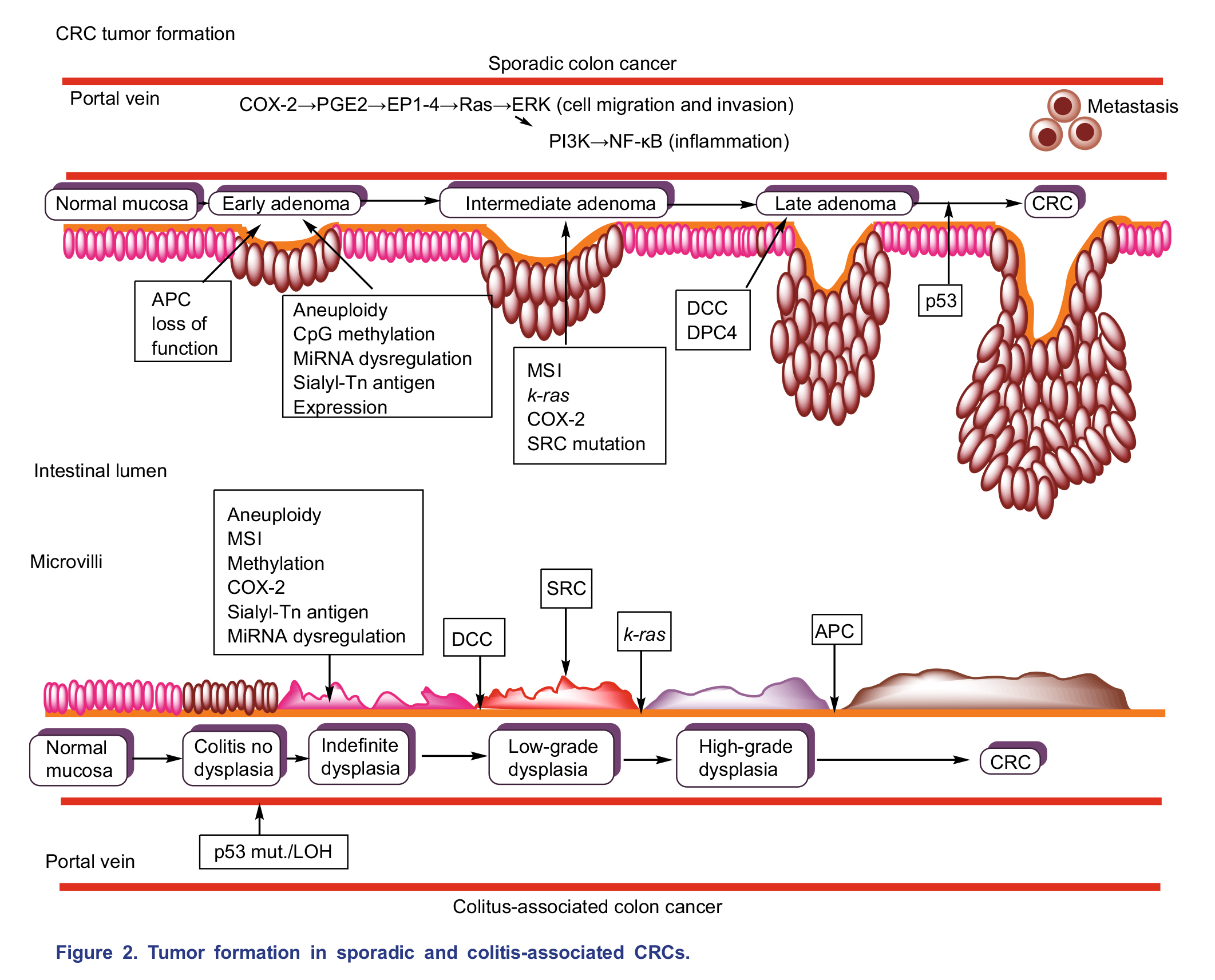
通常,CRC早期阶段的特征是共生细菌丰度(如乳酸杆菌、双歧杆菌和梭状芽孢杆菌)减少,这些菌群可产生具有抗炎性的短链脂肪酸(SCFAs),并且与肠上皮受损标志物(如二胺氧化物,D-乳酸和LPS)呈负相关;具核梭杆菌和大肠杆菌(pks +)与二胺氧化物、D-乳酸、LPS正相关。具核梭杆菌可与CRC肿瘤细胞直接相互作用,其中粘附素FadA与CRC细胞表面的E-钙粘着蛋白结合并激活Wnt /β-catenin信号传导。此外,许多尚未被明确鉴定的细菌也可能在CRC的癌变和进展中发挥作用。
HCV中肠道菌群变化
多项研究表明,除了肝癌不同阶段,HCV感染阶段也是导致肠道菌群组成变化的原因。HCV感染可分为四个阶段:1)血清丙氨酸氨基转移酶(PNALT)持续正常;2)慢性肝炎(CH);3)肝硬化(LC);4)HCC。
Aly等针对6名没有其他潜在疾病的慢性4期HCV患者以及来自同一地区的8名健康对照(HC)进行的粪便微生物组研究结果表明, HCV患者的微生物群落丰富度和多样性降低(已报道多样性降低提示存在慢性炎症)。HCs中丰度升高菌群大多数是植物多糖和纤维发酵相关细菌以及其他共生细菌,如Ruminococcus,Clostridium,Lachnospira,Bacteroides。Lachnospira,Butyricimonas和Clostridium,尤其是XIVa和IV簇产乙酸和丁酸的细菌,具有消炎作用并促进结肠细胞恢复正常。Bifidobacterium和Bacteroides含有胆盐水解酶,可将结合型胆汁酸代谢成非结合型胆汁酸从而通过胆汁酸信号通路发挥作用。共生细菌Parabacteroides可以通过次级胆汁酸信号传导以及琥珀酸激活的肠道糖异生发挥代谢益处。从HCV到HCC发展过程中会产生相当多的抗炎菌,其中一些菌群具有免疫调节作用。这是因为随着肿瘤发展,它需要与其周围环境保持稳态才能生存,因此更需要一种抗炎、免疫抑制的肿瘤微环境。
Heidrich等研究阐述丙型肝炎病毒感染引起的肝硬化中肠道菌群变化,95例慢性HCV患者(57例无肝硬化患者(NCIR);38例肝硬化患者(CIR))和50例健康对照,从HC到NCIR再到CIR,微生物多样性呈显著降低,且alpha多样性也是依次降低。HCV感染本身可以引起促炎柠檬酸杆菌属出现而梭状芽胞杆菌降低,从而为细菌向肝脏移位提供了条件。在纤维化的NCIR阶段,更多梭菌属减少,促炎菌属增加,进一步增加了肠道和肝脏的炎症环境。CIR阶段向促炎性发展进一步发展。Inoue等对丙型肝炎不同阶段肠道菌群组成变化展开研究,纳入23例HC(健康组),18例PNALT(持续正常的丙氨酸转氨酶),84例CH(慢性肝炎),40例LC(肝硬化)和24例HCC患者。肝癌患者微生物多样性下降,并随疾病临床严重程度而降低(HCC< LC < CH < PNALT << HC)。其中PNALT 与CH之间梭状芽孢杆菌属、瘤胃球菌属和链霉菌科丰度降低,而这些菌都是产生短链脂肪酸(SCFA)的共生菌,这表明通过SCFA对炎症调控能力降低。
HBV肠道菌群变化
Wang等对肝损害和代谢异常发生之前的早期CHB患者进行菌群分析,以确定肠道失调是否在肝病发生之前出现以及是否导致了肝脏疾病的发生。CHB患者中丰度降低的菌群导致SCFA和抗菌肽的产生减少,而CHB患者中丰度增加的细菌与宿主的临床检验指标和血清代谢物的积累紧密相关,如胆固醇、L-天冬氨酸、L-酪氨酸、L-苯丙氨酸、辛酸和1-萘酚。其中芳香族氨基酸(如L-苯丙氨酸和L-酪氨酸)可能影响脑功能,并在肝性脑病中发挥重要作用。Zeng等纳入HC(n = 15)、CHB(n = 21)、LC(n = 25)和HCC(n = 21)进行肠道菌群组成分析,不过与之前研究结果不同的是,双歧杆菌在所有阶段均减少,但在HCC中减少程度降低;发现Dorea(一种促炎细菌)随CLD阶段的增加而增加;粪球菌属在CHB和LC中增加,在HCC中降低;罗斯氏菌属在疾病阶段出现降低。
HBV和非肝炎病毒相关HCC中肠道菌群变化
Liu等对肝炎病毒诱发的HCC与非病毒诱发的HCC相关肠道菌群组成变化进行分析,结果显示两种病因引发的肝炎和肝硬化过程中肠道菌群变化是不同的。产内毒素的促炎菌埃希氏杆菌属-志贺氏菌属、肠球菌和变形杆菌丰度在非病毒性HCC中升高,在HBV-HCC中丰度降低。非病毒性HCC组中,Firmicutes门中多种促进炎症的菌群水平显著减少。整体来说,相对于HBV-HCC,非病毒性HCC似乎具有更强的促炎性,表明非病毒性HCC的肿瘤微环境也可能略有不同。这可能是因为非病毒性肝癌始于慢性发炎,而病毒性肝癌始于剧烈的免疫原性应答。Xie等利用HCC小鼠模型探讨了胆汁酸组成与非病毒性肝病不同阶段的关联。通过检测胆汁酸变化评估肠道菌群对肿瘤微环境的影响。在这项研究中,使用高脂饮食和肿瘤诱导剂链脲佐菌素联合诱导HCC小鼠,在每个阶段(脂肪变性、纤维化、肝硬化和肝癌)进行肝、粪便胆汁酸分析及粪便菌群分析。从这些数据中可以发现,与疾病阶段负相关的菌群倾向于降低肝脏中促炎胆汁酸,而与疾病阶段正相关的菌群则倾向于增加肝脏中的胆汁酸。
CRC中肠道菌群变化
CRC相关菌群可分为三种不同的模式。第一种模式,从0期到更晚期阶段一些促炎细菌,如Fusobacterium nucleatum、Peptostreptococcus anaerobius、Peptostreptococcus stomatis等丰度一直升高,Parvimonas micra.、P. anaerobius、P. stomatis、P. micra在Ⅰ/Ⅱ和Ⅲ/Ⅳ为主要菌群,但在术后其丰度降低;第二种模式,Atopobium parvulum和Actinomyces odontolyticus等菌群丰度在多息肉状腺瘤和/或0期增加,但在更晚期则没有增加。第三种模式,抗炎微生物或某些益生菌,例如产丁酸盐菌(Lachnospira multipara和Eubacterium eligens)和长双歧杆菌,随着CRC的发展而降低。Feng等对55例HC、42例晚期腺瘤和41例癌症患者进行粪便宏基因组测序,结果发现,尽管存在少量抗炎微生物,但相对于腺瘤阶段,CRC菌群是相对促炎的。CRC与HCC中的肠道菌群结构的不同,提示CRC的TME与HCC有所不同。
对于HCV-HCC、HBV-HCC、非病毒感染 HCC、CRC相关菌群进行整理(表10)[J1] ,可以看出CRC相关菌属比HCC菌群多一些。三种类型的HCC,肠道菌群的变化存在显著差异。对于不同类型癌症,某些菌群的趋势存在相反现象。


小结
本综述探讨了各种类型HCC以及CRC肿瘤微环境是否相似。通过阻断血液供应来“饿死肿瘤”的思路同样适用于肠道菌群调节肿瘤微环境。通过调节肠道菌群改善营养或免疫,进而调控肿瘤微环境,达到治疗效果。此外,还需要更多的研究以解决肠道菌群与疾病病因和/或阶段之间的关系。
参考文献
Wei Jia, et al. Gut microbiota alterations are distinct for primary colorectal cancer and hepatocellular carcinoma. Protein & Cell, August 14, 2020. https://doi.org/10.1007/s13238-020-00748-0.
原文阅读,请长按识别下方二维码

精彩推荐
1. 肠·道 | 贾伟:肝病肠治?且看肠道细菌如何对肝病推波助澜!
2. Nature Medicine | 代谢组学和宏基因组学共同揭示CRC与肠道菌群的关系
3. International Journal of Cancer | 前瞻性研究:与结直肠癌风险相关的血液代谢物
4. Cell | 可溶性纤维的微生物发酵失调诱导胆汁淤积性肝癌

