不仅Mirrorball提供了和ABI 8200一样的高灵敏度,而且与ABI 8200只能扫描1 mm2的区域相比,它能够扫描整个孔内的细胞并且不受细胞分布的影响(图4)。由于ABI 8200有限的扫描区域,往往需要较高的细胞数目来获得更具有统计学意义的结果。
图4 Mirrorball和ABI 8200扫描区域的对比
使用Mirrorball 可以大幅度的减少每孔中细胞的用量,这对一些生长缓慢比较少量的细胞系特别适用,可以节省实验的消耗。
Mirrorball的软件Cellista能够像ABI 8200一样进行数据的处理并直接呈现出hit孔的位置,这个功能可以使我们兼容之前ABI 8200上的实验数据。这里EGFR实验就是个很直接的案例,不需要改变现有的protocol可以直接在Mirrorball上进行实验。
图5 使用每个微珠或细胞的平均荧光强度来代表hit
讨论
均相反应和“混合即读数一步法检测”模式特别适合生物医药研发,尤其在高通量抗体药物筛选阶段。因为这种模式能减少洗板和孵育的次数并增强检测的灵敏度,对比传统的ELISA大大缩短了实验时间,提高了实验通量。同时也要比流式细胞仪等仪器更有优势,也可以减少细胞和试剂的用量。
这里我们比较了Mirrorball和ABI 8200的检测灵敏度,实验结果表明Mirrorball的灵敏度同样优异,可以将原有在ABI 8200上进行的实验直接转移到Mirrorball上进行。
Mirrorball是第一台能够完成多重激光同时扫描的仪器,能够同时将不同荧光关联起来。当使用不同的荧光染料的时候,特别是应用在抗体筛选的实验时候,这种特性就能提供卓越的多重荧光的检测能力,
包括同时检测多种抗原或者同时检测不同标记的细胞表面抗原的能力(例如,野生型和转基因细胞系)。
总体上,TTP Labtech的Mirrorball 微孔板细胞仪的“混合即读数”检测方法能够为可溶性抗原或细胞表面抗原的检测提供最稳健的数据结果。自动化的抗体筛选技术整合混合即读数的实验方式,将高灵敏度检测和高内涵抗体筛选有机结合起来,可以提高药物筛选的效率。因此,Mirrorball也是一个非常理想的ABI 8200的替代产品,将成为下一代的抗体筛选平台。
,
以抗体技术为基础的免疫检测应用和相关的疾病治疗领域如癌症,自身免疫系统疾病等一直推动着抗体筛选的研究。单克隆抗体由特定的细胞系分泌到上清液中,而对上清液中特异性抗体的筛选则成为了药物初期研发的核心领域。
均相结合实验
尽管ELISA和流式细胞仪等传统手段被广泛应用,但是这两种检测手段都存在各自的局限性,特别是对细胞表面低表达抗原的检测。同时,这两种平台需要很繁琐的洗板和孵育的步骤而且耗费大量细胞和时间才能获取数据。为了解决这些技术瓶颈,我们开发了Mirrorball这个高灵敏度检测平台和“混合及读数之一步法检测”的实验方案,这样就大幅度地提高了抗体筛选的通量并且避免了繁琐的实验步骤。您所需要进行的实验仅仅是将所有的反应物一次性地加入到孔中并孵育一段时间。这里待检测的可以是结合在微球上的可溶性抗原也可以是细胞表面表达的抗原,一旦反应达到平衡状态,那么结合了待测抗体的微珠或细胞可以很快地通过荧光标记的二抗来检测到。相比于流式和传统ELISA,Mirrorball通过一种均相免洗的方式,让您利用最少的试剂耗材、最低的时间、人力成本以及更高的通量和自动化整合来进行抗体药物的初筛。希望给您带来最为简便和高效的抗体药筛选体验,别适用于研究昂贵和低丰度的抗原。
均相抗体结合实验的分析
Mirrorball和另一款类似产品ABI 8200 FMAT 都在设计上融入了很多适用于均相结合实验的特性。通过使用激光作为激发光源和光电倍增管作为检测装置,这使得它们能够检测到低亲和力的抗体和低丰度的抗原的结合。两个系统都在光路设计上最大程度的降低了背景荧光并在扫描读数的时候大幅度的提高了信噪比。在这个应用介绍里我们特别的比较了两个平台 Mirrorball和ABI 8200 在通过细胞水平实验进行抗体筛选时的性能优异性。通过对比,我们展示了Mirrorball的多重荧光检测能力,这使多重抗原标记并同时检测成为了可能。
方法
细胞系和培养方法
在这项研究中,比较了Mirrorball和ABI8200系统在进行A431细胞EGFR抗体结合实验时的。 A431细胞在EMEM培养(EBSS)(Sigma公司)含10%胎牛血清,2mM谷氨酰胺(Sigma公司),1X非必需氨基酸(NEAA)(Sigma)和100 U / mL青霉素以及100 U / ml链霉素。 A431细胞培养至80%汇合度时用0.25%胰蛋白酶和EDTA收集,洗净悬浮在培养基中。除非另有说明,培养试剂均购自Life Technology。
抗体和试剂
检测抗体,鼠抗人表皮生长因子抗体(抗EGFR抗体),购自Merck Chmicals Ltd(#GR01)。山羊抗鼠IgG,AlexaFluor647 (#A21235)由Life Technologies公司提供。
CFSE标记
5(6) - 羧基二乙酸N -琥珀酰亚胺酯(CFSE)(Sigma公司)配置为100mM在DMSO溶液里。 CFSE(10nM)被添加到细胞里并在室温中孵育10分钟。用4%FBS的PBS(2ml)终止反应。进一步孵化,于37° C下10分钟后,细胞1000 x g离心5分钟。
EGFR实验
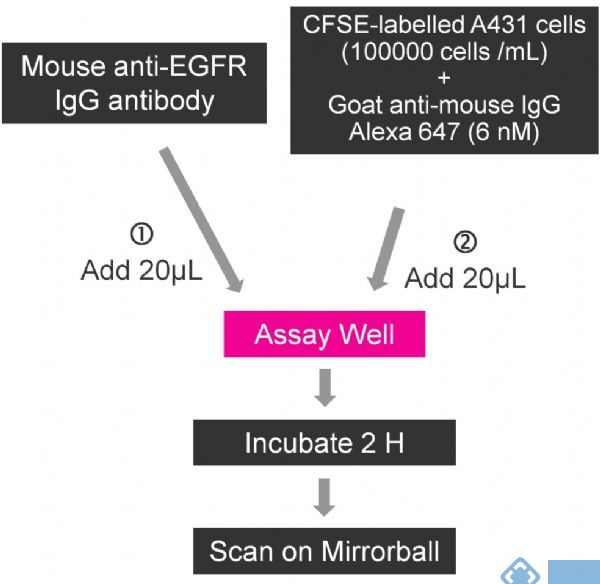
抗EGFR抗体在培养基中梯度稀释,并添加20ul到384孔板中(Costar#3712)。对于Mirrorball系统,暂停用CFSE标记A431细胞含有1 ×105个细胞/ mL和6nM抗鼠IgG AlexaFluor647二抗。对于ABI的8200平台,准备A431细胞的悬浮液包含4× 105细胞/ mL和6nM抗鼠IgG AlexaFluor647。首先,加入在各孔中加入20uL混合有荧光二抗的细胞悬液在37℃,孵育2小时。分别在Mirrorball和ABI8200平台上进行扫描并测定结合有EGFR抗体的细胞数量。最后,Mirrorball和ABI8200的浓度分别为2000细胞/孔和8000细胞/孔,3 nM抗体结合(图1)。
图1. Mirrorball表皮生长因子受体检测示意图(ABI 8200的实验protocol基本一致,除了加入的A431浓度为4 X 105细胞/ ml)。
Mirrorball的数据扫描和获取
微孔板进行扫描,使用488和640纳米的指定激光器。每孔中的细胞都会 “on”使用TTP LabTech公司
**的阈值算法和两种形态荧光参数前面所述报告鲍文和卫理(1)。全井扫描和数据可视化中的各种方式,包括直方图或散点图,3D荧光强度分布,或整个以及使用Mirrorball的图像Cellista™软件。
ABI 8200的数据扫描和获取
使用640 nm激光扫描样品。进行细胞计数和荧光总强度导出到Excel文件和处理如 Lee et al(2)。实验数据仅仅收集了孔中心1 mm2的面积大小的区域。
数据结果
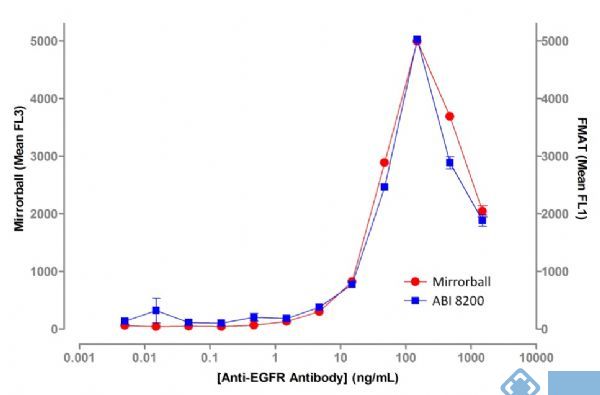
为了比较Mirrorball和ABI 8200在EGFR检测灵敏度方面的差异性,将A431细胞与梯度稀释的EGFR一抗以及AlexaFluor647标记的goat anti-mouse IgG二抗共同孵育。 在用Mirroball分析时,用CFSE对细胞进行染色,预先定位细胞并进行计数,细胞量为384孔板每孔2000个。对于ABI的8200, A431细胞量为每孔8000个接种。
图2表明,Mirroball检测灵敏度和ABI 8200 一样,从5 ng /ml抗EGFR抗体浓度开始,荧光随着浓度升高而逐渐加强。两种方法在一抗浓度高于100ng/ml的时候,都检测到了一个较强的荧光减少。这也是报道过的 “钩状效应”(2)。在这里,主要是过量的一抗过饱和了,阻止了荧光二抗的结合和最终的实验读数。
图2 抗EGFT抗体和 A431细胞结合的抗体浓度依赖的荧光强度曲线
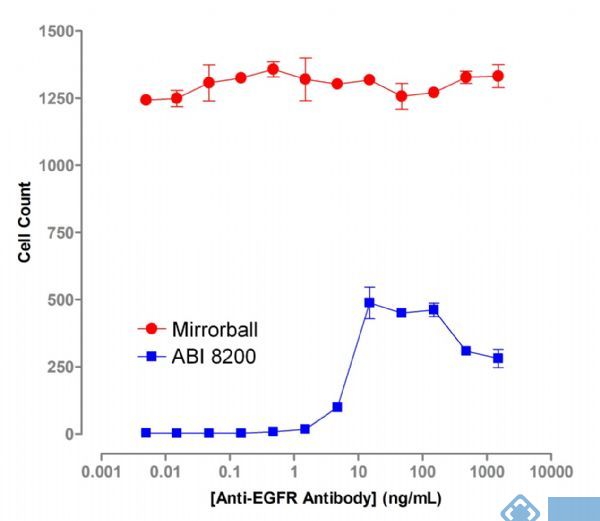
Mirrorball的多激光能力提供了一个独有的优越性,对细胞的识别不会受到较低抗体结合的影响。而ABI 8200只配备了单一的640 nm激光,因此也只能检测高过背景的荧光。然而,在使用Mirrorball 时由于用CFSE(488nm)染料对细胞进行单独染色,细胞的计数就不再依赖荧光抗体的结合(图3)。可靠的细胞计数也同时增加了数据的稳健性。
图3 Mirrorball允许不依赖荧光抗体的结合量来测量CFSE标记的细胞。而在
地 址: https://www.sptlabtech.cn/ 联系人: 官网已开通在线询价 电 话: 021-51088608 传 真: 021-51821822 Email:marketing@sptlabtech.cn
SPT Labtech推出firefly®,为基因组学液体处理开启新时代
(2023-04-06T14:01 浏览数:16569)
全自动单管存取:化合物管理的未来
(2016-12-01T10:07 浏览数:16531)
让膜蛋白触手可及
(2016-12-01T10:08 浏览数:27922)
免疫分析变革技术U-PLEX,轻松DIY多因子检测
(2016-09-19T14:14 浏览数:17061)
ABI 8200 FMAT的理想替代技术:“混合即读一步法检测”模式,给您带来不用于ELISA和流式的抗体筛选新体验
(2016-09-19T14:10 浏览数:17446)
看MRC的科学家如何快速、直接进行大分子结晶条件优化
(2016-12-01T10:08 浏览数:13661)
生物样本库之后:基于细胞水平的表型分析在转化医学的应用
(2016-09-19T13:52 浏览数:16019)
BlueWasher——世界首款离心式洗板机
(2016-12-01T10:07 浏览数:15997)
上海腾泉生物科技有限公司
商家主页
相关咨询